-
化学与生产、生活密切相关。下列有关叙述正确的是
A. “一带一路”被誉为现代丝绸之路,丝绸属于纤维素
B. 电解水制氢气可缓解能源危机,实现节能环保
C. “雨后彩虹”是一种与胶体有关的自然现象
D. 烧制“明如镜、声如磬”的瓷器时未涉及化学变化
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 0.1 mol NaHSO4固体中含有的离子总数为0.3NA
B. 1L 1 mo1·L-1的(NH4)2CO3溶液中所含NH4+的数目为2NA
C. 标况下,22.4L Cl2通入水中,转移的电子数为NA
D. 20g D2O含有的中子数为10NA
难度: 中等查看答案及解析
-
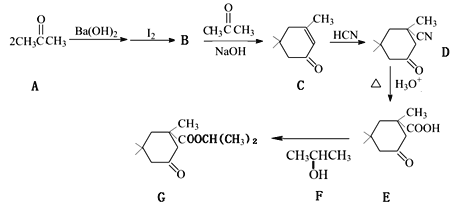
由环戊二烯(a)制备金刚烷(d)的合成路线如下图所示。下列说法正确的是
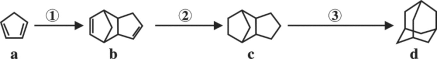
A. 物质a中所有原子一定在同一个平面上
B. 物质b能使溴水或酸性高锰酸钾溶液褪色
C. 物质c、d互为同系物
D. 物质d的一氯代物有3种
难度: 中等查看答案及解析
-
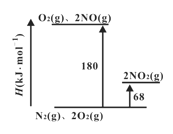
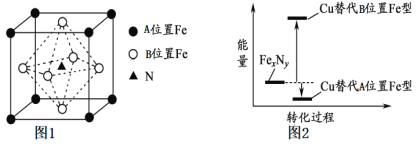
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子且与W同主族,Z是短周期金属性最强的元素。下列说法不正确的是
A. X、Z的简单离子具有相同的电子层结构
B. X、Z只能形成仅含有离子键的化合物
C. W的简单气态氢化物热稳定性比Y的弱
D. 原子半径:r(Y)<r(X)<r(W)<r(Z)
难度: 中等查看答案及解析
-
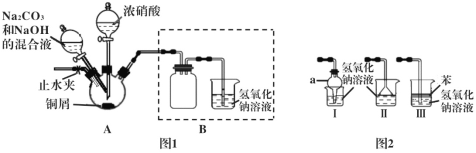
下列实验不能达到目的的是
A. 配制一定物质的量浓度的NaOH溶液
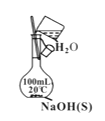
B. 检验火柴头燃烧产生的SO2

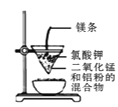
C. 制金属锰
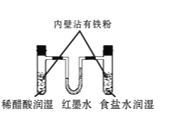
D. 模拟钢铁的腐蚀
难度: 中等查看答案及解析
-
利用微生物可实现苯酚(
)废水的净化,装置如图所示。下列有关说法正确的是
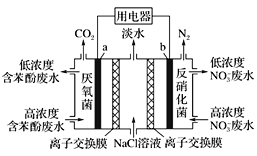
A. a极的电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
B. b极为正极,发生氧化反应
C. 中间室的Na+向左室移动
D. 右室生成0.1 mol N2时,用电器流过0.5 mol电子
难度: 中等查看答案及解析
-
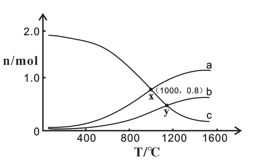
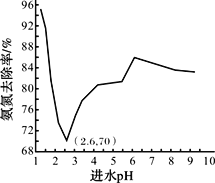
常温下,向0.1 mo1·L-1的NH4HCO3溶液中逐滴加入NaOH,溶液中部分含氮、含碳微粒的分布情况如下图所示。下列说法不正确的是
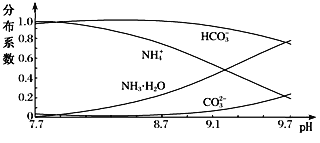
A. 开始阶段,HCO3- 增加的原因可能是:HCO3-的水解平衡逆向移动
B. pH在8.7~9.7之间,HCO3-和NH4+同时与OH-反应
C. 通过分析可知常温下:Kb(NH3·H2O)<Ka1(H2CO3)
D. pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
难度: 中等查看答案及解析