-
元素的性质呈周期性变化的根本原因是 ( )
A. 元素的金属性和非金属性呈周期性变化
B. 随着元素相对原子质量的递增,量变引起质变
C. 原子半径呈周期性变化
D. 元素原子核外电子排布呈周期性变化
难度: 简单查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
难度: 中等查看答案及解析
-
下列有关化学能与热能的说法正确的是( )
A. 铝热反应属于吸热反应
B. 若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应
C. H2→H+H的变化需要吸收能量
D. 凡经加热而发生的化学反应都是吸热反应
难度: 中等查看答案及解析
-
下列各组物质互为同分异构体的是( )
A. 甲烷和乙烷 B. 甲烷和丁烷 C. 乙烷和乙烯 D. 正丁烷和异丁烷
难度: 简单查看答案及解析
-
下列反应属于取代反应的是
A. CH4+2O2
CO2+2H2O
B. Zn+CuSO4====ZnSO4+Cu
C. CH4
C+2H2
D. CH2Cl2+Cl2
CHCl3+HCl
难度: 简单查看答案及解析
-
下列物质中,只含有离子键的化合物是( )
A. H2O B. CaCl2 C. KOH D. Cl2
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 参加反应的反应物的性质是决定化学反应速率的主要因素
B. 光是影响某些化学反应速率的外界条件之一
C. 决定化学反应速率的最主要因素是浓度
D. 增大浓度、加热、加压或使用催化剂,都是加快反应速率方法
难度: 简单查看答案及解析
-
下列关于铜锌原电池(如图所示)的说法正确的是( )
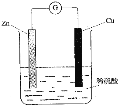
A. Zn是负极,发生还原反应
B. Cu是负极,发生氧化反应
C. 铜片上有气体逸出
D. 电子由铜片通过导线流向锌片
难度: 中等查看答案及解析
-
据报道,某些建筑材料会产生放射性同位素氡
,从而对人体产生伤害,该同位素原子的中子数和质子数之差是( )
A. 136 B. 50 C. 86 D. 222
难度: 简单查看答案及解析
-
下列关于CH4的说法错误的是( )
A. CH4是沼气、天然气和煤矿坑道气的主要成分 B. 甲烷不能使酸性KMnO4溶液褪色
C. 收集甲烷可以用向下排空气法 D. 甲烷和氯水光照时发生取代反应
难度: 简单查看答案及解析
-
一定条件下,可逆反应H2(g)+I2(g)
2HI(g)达到化学平衡状态。下列说法正确的是
A. 该反应达到最大限度 B. 各物质的浓度一定相等
C. 正逆反应速率均为零 D. 反应物全部转化为生成物
难度: 简单查看答案及解析
-
已知反应:2Al + Fe2O3
Al2O3 + 2Fe为放热反应。下列说法正确的是( )
A. 升高温度,该反应速率减慢
B. 由该反应可知铁比铝活泼
C. 反应物的总能量一定大于生成物的总能量
D. 因该反应为放热反应,故不必加热就可发生
难度: 中等查看答案及解析
-
下列做法的目的与反应速率有关的是
A. 用冰箱冷藏食物 B. 制作糖果过程中添加着色剂
C. 食盐中添加碘酸钾 D. 制作糕点时加白糖
难度: 简单查看答案及解析
-
在一定条件下,反应N2+3H2
2NH3在10 L恒容密闭容器中进行,测得2 min内N2的物质的量由20 mol减少到8 mol,则2 min内N2的化学反应速率为
A. 1.2 mol/(L·min) B. 1.0 mol/(L·min)
C. 0.6 mol/(L·min) D. 0.4 mol/(L·min)
难度: 中等查看答案及解析
-
在2L密闭容器中发生反应A(g)+3B(g)
2C(g),30s内C的物质的量增加了0.6mol,下列关于速率表示正确的是( )
A. v(A)=0.005mol·L-1·s-1 B. v(C)=0.002 mol·L-1·s-1
C. v(B)=0.003 mol·L-1·s-1 D. v(A)=0.001mol·L-1·s-1
难度: 简单查看答案及解析
-
下列试管中,不同条件下反应:Fe+2HCl=FeCl2+H2↑,判断产生H2的反应速率最小的是
试管
盐酸浓度
温度
铁的状态
A
0.5 mol/L
20 ℃
块状
B
0.5 mol/L
20 ℃
粉末状
C
2 mol/L
35 ℃
粉末状
D
1 mol/L
35 ℃
块状
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
化学反应中的能量变化,通常主要表现为热量的变化——吸热或者放热。下列有关说法不正确的是
A. 氢气在氧气中燃烧和在空气中燃烧都是放热反应
B. 煤的燃烧需要加热点燃,故是吸热反应
C. 放热反应的反应物的总能量高于生成物的总能量
D. 煅烧石灰石制生石灰是吸热反应
难度: 简单查看答案及解析
-
已知Zn+H2SO4=ZnSO4+H2↑下列措施能使产生氢气的速率加快的是
A. 将锌粉替换为锌片 B. 向反应的溶液中入氯化钠溶液
C. 将锌与稀硫酸的反应温度升高 D. 向反应的溶液中加入硫酸钠固体
难度: 简单查看答案及解析
-
如图:某温度时,在2 L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为:
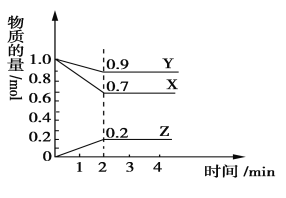
A. X+Y=Z B. 3X+Y
2Z C. 2X+2Y
Z D. X+3Y
2Z
难度: 简单查看答案及解析
-
针对上题,反应开始至2 min,Z的平均反应速率为( )
A. 0.05 mol/(L·s) B. 0.01 mol/(L·s)
C. 0.01mol/(L·min) D. 0.05 mol/(L·min)
难度: 简单查看答案及解析
-
下列装置中能够形成原电池的是
A.
 B.
B. 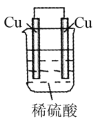
C.
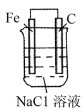 D.
D. 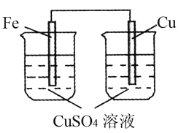
难度: 简单查看答案及解析
-
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X表面有Z析出,X与Y组成原电池时,Y为负极。则X、Y、Z三种金属的活动性顺序为( )
A. X>Y>Z B. X>Z>Y C. Y>X>Z D. Y>Z>X
难度: 中等查看答案及解析
-
已知空气-锌电池的电极反应为:
锌粒:Zn + 2OHˉ— 2eˉ= ZnO + H2O
石墨:O2 + H2 + 2eˉ = 2OHˉ。
根据判断,锌片
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
难度: 中等查看答案及解析
-
以铁片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2mol电子时,下列说法正确的是( )
A. 铁片溶解1 mol,铜片上析出1 mol H2
B. 两极上溶解和析出的物质的质量相等
C. 铁片溶解2 g,铜片上析出1 g H2
D. 铁片溶解1 mol,转移电子1 mol
难度: 简单查看答案及解析
-
废电池处理不当不仅造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是
A. 把锌皮取下洗净用于实验室制取氢气
B. 碳棒取下用作电极
C. 把铜帽取下洗净回收利用
D. 电池内部填有氯化铵等化学物质,将废电池中的黑色糊状物用作化肥
难度: 中等查看答案及解析
-
日常所用干电池其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质,电极反应可简化为Zn-2e-=Zn2+,2NH4++2e-=2NH3↑+H2↑(NH3再用于结合Zn2+)。根据上述叙述判断下列说法中正确的是( )
A. 干电池中Zn为正极,碳为负极
B. 干电池工作时,电子由碳极经外电流路向Zn极
C. 干电池长时间连续使用时内装糊状物可能流出腐蚀电器
D. 干电池可以实现化学能向电能的完全转化
难度: 简单查看答案及解析
-
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-=4H2O、O2+2H2O+4e-=4OH-,错误的是( )
A. 氧气通入正极发生氧化反应 B. 燃料电池的能量转化率不能达到100%
C. 供电时的总反应为:2H2+O2=2H2O D. 产物为无污染的水,属于环境友好电池
难度: 简单查看答案及解析
-
据报道,美国正在研究的锌电池可能取代目前广泛使用的铅酸蓄电池。锌电池具有容量大、污染少等优点。电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。下列叙述正确的是( )
A. 锌为正极,空气进入负极反应 B. 负极反应为Zn+2OH--2e-=ZnO+H2O
C. 正极发生氧化反应 D. 电解液可以是乙醇
难度: 简单查看答案及解析
-
下列有关电池的说法不正确的是
A. 手机上用的锂离子电池属于二次电池
B. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C. 甲醇燃料电池可把化学能转化为电能
D. 锌锰干电池中,锌电极是负极
难度: 中等查看答案及解析
-
下列有关电池的叙述正确的是( )
A. 锌锰干电池工作一段时间后碳棒变细
B. 氢氧燃料电池可将热能直接转变为电能
C. 氢氧燃料电池工作时氢气在负极被氧化
D. 太阳能电池主要材料是高纯度的二氧化硅
难度: 简单查看答案及解析