-
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF—F 、S—F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A. -1780kJ·mol-1 B. -1220 kJ·mol-1 C. -450 kJ·mol-1 D. +430 kJ·mol-1
难度: 中等查看答案及解析
-
用稀硫酸与过量锌粒反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施不可行的是
A. 升高温度 B. 滴加少量浓硫酸
C. 滴加少量硫酸铜溶液 D. 改用等质量的锌粉
难度: 简单查看答案及解析
-
2017年8月,四川九寨沟地震造成了重大人员财产损失。地震救援中需要使用大量的消毒剂,下列消毒剂属于强电解质的是( )
A. 次氯酸 B. 二氧化氯 C. 酒精 D. 高锰酸钾
难度: 中等查看答案及解析
-
向饱和石灰水中投入0.56g氧化钙,并恢复到原来的温度,下列说法正确的是( )
A. 溶液的pH增大 B. 溶液中c(Ca2+)不变
C. OH-数目不变 D. 析出的Ca(OH)2质量为0.74g
难度: 中等查看答案及解析
-
与纯水的电离相似,液氨中也存在着微弱的电离:2NH3⇌NH4++NH2﹣,据此判断以下叙述中不正确的是( )
A. 液氨中含有NH3、NH4+、NH2﹣微粒
B. 其他条件不变,若增加液氨的量,电离平衡将正向移动
C. 只要不加入其他物质,液氨中c(NH4+)=c(NH2﹣)
D. 一定温度下液氨中c(NH4+)• c(NH2﹣)是一个常数
难度: 中等查看答案及解析
-
在一个体积恒定的密闭容器中,加入2molA和1molB发生反应:2A(g)+B(g)⇌3C(g)+D(g),一定条件下达到平衡时,C的浓度为Wmol•L-1,若容器体积和温度保持不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol•L-1的是( )
A. 4molA+2molB B. 3molC+1molD
C. 2molA+1molB+3molC+1molD D. 1molA+0.5molB+3molC+1molD
难度: 中等查看答案及解析
-
对于反应A(g)+4B(g) = 2C(g)+2D(g),下列数据表示反应进行得最快的是( )
A. v(A)=1.4mol/(L·s) B. v(B)=3.6mol/(L·s)
C. v(C)=2mol/(L·s) D. v(D)=3.0mol/(L·min)
难度: 简单查看答案及解析
-
下列说法正确的是
A. 增大反应物浓度,可增大单位体积内活化分子的百分数从而使有效碰撞次数增大
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 催化剂不影响活化能但能增大单位体积内活化分子百分数,从而增大反应速率
D. 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
难度: 简单查看答案及解析
-
下列有关中和热实验的说法正确的是
A. 用铜丝替代环形玻璃搅拌棒,测得△H偏高
B. 强酸与强碱反应生成的水越多,该反应的中和热越大
C. 强酸与强碱反应生成1mol水的△H都约为-57.3 kJ•mol﹣1
D. 测定中和热实验中,读取混合溶液不再变化的温度为终止温度
难度: 简单查看答案及解析
-
下列说法正确的是
A. 对于任何化学反应来说,反应速率越大,反应现象就越明显
B. 催化剂能增大单位体积内活化分子百分数,从而增大反应速率
C. 放热反应都是自发的,吸热反应都是非自发的
D. 化学反应速率通常是指一定时间内反应物的物质的量减少或生成物的物质的量增加
难度: 中等查看答案及解析
-
一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2—
下列说法不正确的是
A. 在pH<4溶液中,碳钢主要发生析氢腐蚀
B. 在pH>6溶液中,碳钢主要发生吸氧腐蚀
C. 在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D. 在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会减缓
难度: 困难查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是
A. 用10mL量筒量取7.13mL稀盐酸
B. 用托盘天平称量25.20g NaCl
C. 用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
D. 用广泛pH试纸测得某溶液的pH为2.3
难度: 简单查看答案及解析
-
下列不属于新能源开发利用的是( )
A. 太阳能热水器
 B. 天然气动力汽车
B. 天然气动力汽车
C. 潮汐能发电
 D. 风能发电
D. 风能发电
难度: 简单查看答案及解析
-
下列事实可以用勒夏特列原理解释的是( )
A. 新制的氯水在光照条件下颜色变浅
B. 使用催化剂,提高合成氨的产量
C. 高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
D. H2、I2、HI平衡混合气体加压后颜色变深
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中一定大量共存的是( )
A. 含有AlO2-的溶液中:Na+ 、Al3+、Cl-、K+
B. 常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中:Na+、NH
、Cl-
C. 常温下 c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
D. 在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
难度: 中等查看答案及解析
-
下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
难度: 简单查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
下列说法不正确的是
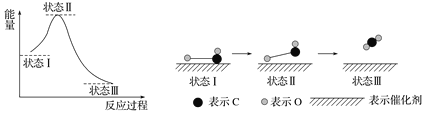
A. CO和O生成CO2是放热反应。
B. 在该过程中,CO分子中碳氧键没有断裂成C和O。
C. 在该过程中,O与CO中C结合形成共价键。
D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程。
难度: 中等查看答案及解析
-
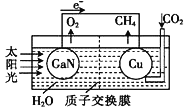
有关电化学知识的描述正确的是

A. Cu+H2SO4= CuSO4+H2↑这个反应可设计成原电池。
B. 利用Cu+2FeCl3=CuCl2+2FeCl2,可设计如图所示原电池装置,盐桥内K+向FeCl3溶液移动。
C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-=Fe2+。
D. 由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-=Mg(OH)2。
难度: 中等查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+O2(g)在恒容密闭容器中反应,达到平衡状态的标志是①单位时间内生成n molO2 的同时消耗 2n mol NO;②单位时间内消耗2n molNO2的同时生成n molO2;③混合气体的颜色不再改变的状态;④2v(NO2)正= v(O2)逆;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体的密度不再改变的状态
A. ①③⑤ B. ②④⑥ C. ①③④⑤ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A. 使体积不变,增加H2O的量 B. 将容器的体积缩小一半
C. 使体积不变,充氦气使体系压强增大 D. 使压强不变,充氦气使容器体积增大
难度: 简单查看答案及解析
-
已知胆矾溶于水时溶液温度降低,室温下将1 mol无水硫酸铜制成溶液时放出热量为Q1。而胆矾分解的热化学方程式为:CuSO4·5H2O(s)===CuSO4(s)+5H2O(l);ΔH=+Q2 kJ·mol-1则Q1和Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
难度: 困难查看答案及解析
-
室温时,CH3COOH的电离平衡常数为K,向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是( )

A. b点表示的溶液中c(Na+)>c(CH3COO﹣)
B. c点表示CH3COOH和NaOH恰好反应完全
C. d点表示的溶液中c(CH3COO﹣) c(H+)/c(CH3COOH)大于K
D. b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)═c(CH3COO﹣)+c(OH﹣)
难度: 中等查看答案及解析
-
对下列图像描述正确的是

A. 图①可表示将氨气通入醋酸溶液至过量过程中溶液导电性的变化
B. 根据图②可判断可逆反应A2(g)+3B2(g)
2AB3(g)的ΔH>0
C. 图③表示等体积、等pH的盐酸与醋酸溶液分别与足量的锌粉发生反应产生氢气的体积(V)随时的变化的示意图
D. 图④可表示压强对可逆反应A(g)+B(g)
2C(g)+D(g)的影响,乙的压强大
难度: 困难查看答案及解析