-
下列事实与元素周期律相关知识无关的是( )
A. 向淀粉KI溶液中滴入溴水,溶液变蓝
B. 金属钠燃烧呈现黄色火焰,金属钾燃烧呈现紫色火焰
C. CH4、SiH4、GeH4、SnH4的沸点依次升高
D. F2和H2暗处化合爆炸,而Cl2和H2化合需光照或点燃
难度: 中等查看答案及解析
-
下列关于碱金属和卤素的说法,错误的是 ( )
A. 随着核电荷数的增大,碱金属元素和卤素的原子半径都逐渐增大
B. 碱金属元素中,锂原子失去电子的能力最弱,卤素中氟原子得电子能力最强
C. 钾与水的反应比钠与水的反应更剧烈
D. 溴单质与水反应比氯单质与水反应更剧烈
难度: 简单查看答案及解析
-
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是 ( )
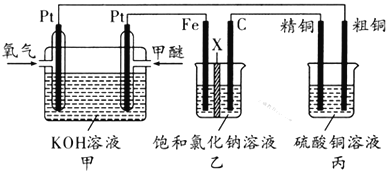
A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B. 乙装置中铁电极为阴极,电极反应式为Fe-2e-
Fe2+
C. 通入氧气的一极为正极,发生的电极反应为O2-4e-+2H2O
4OH-
D. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
难度: 困难查看答案及解析
-
某充电宝锂离子电池的总反应为:xLi+Li1﹣xMn2O4
LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH
M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是( )
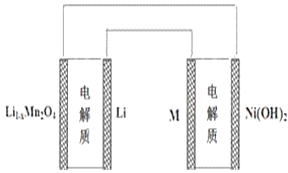
A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e﹣═Ni(OH)2+OH﹣
C. 图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式:LiMn2O4﹣xe﹣═Li1﹣xMn2O4+xLi+
难度: 中等查看答案及解析
-
2010Ne是最早发现的Ne元素的稳定同位素,汤姆逊(J.J.Thomson)和阿斯通(F.W.Aston)在1913年发现了2210Ne。下列有关2210Ne和2010Ne的关系说法正确的是( )
A. 同分异构体 B. 不同的核素 C. 性质相同 D. 同系物
难度: 简单查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是( )
A. 酸性:HCl>HF B. 金属性:Na>Mg
C. 碱性:KOH>NaOH D. 热稳定性:HCl>HBr
难度: 中等查看答案及解析
-
下列关于化学键的叙述正确的是( )
A. 离子化合物一定不含共价键
B. 化学键的形成与原子结构无关
C. 化学键主要通过原子的价电子间的转移或共用来实现
D. 离子键可能存在于共价化合物中
难度: 简单查看答案及解析
-
下列各组化合物中,化学键类型完全相同的是( )
A. CaCl2和Na2S B. Na2O和Na2O2
C. CO2和CaO D. HCl和NaOH
难度: 简单查看答案及解析
-
下列金属用热还原法冶炼的是( )
A. 钠 B. 银 C. 铁 D. 汞
难度: 简单查看答案及解析
-
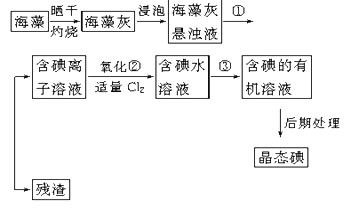
海水提镁的主要流程如下,下列说法正确的是( )
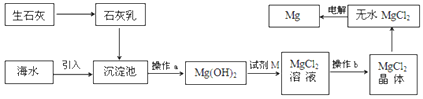
①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
下列酸与碱中和反应热化学方程式可用:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1来表示的是(Q1,Q2,Q3,Q4都大于0) ( )
A. CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
B.
H2SO4(浓)+NaOH(aq)=
Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
C. HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-Q3 kJ·mol-1
D.
H3PO4(aq)+
Ba(OH)2(aq)=
Ba3(PO4)2(s)+H2O(l) ΔH=-Q4 kJ·mol-1
难度: 中等查看答案及解析
-
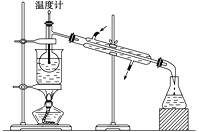
下列有关叙述正确的是( )

A. 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
D. 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
0.096 kg碳完全燃烧可放出3 147.9 kJ的热量 ,则下列热化学方程式正确的是( )
A. C(s)+O2(g)=CO2(g) ΔH=—393.49 kJ/mol
B. C+O2=CO2 ΔH=-393.49 kJ/mol
C. C(s)+O2(g)=CO2(g) ΔH=+393.49 kJ/mol
D. C(s)+
O2(g)=CO(g) ΔH=-393.49 kJ/mol
难度: 中等查看答案及解析
-
已知下列两个热化学方程式:
H2(g) + 1/2 O2(g)
H2O(l) △H=-300KJ·mol-1
C3H8(g) + 5O2(g)
3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放热5000KJ,则混合气体中氢气和丙烷的体积比约为( )
A. 7:10 B. 3:1 C. 10:7 D. 1:3
难度: 困难查看答案及解析
-
下图中左图是铜锌原电池示意图,图中x轴表示实验时流入正极的电子的物质的量,y轴表示
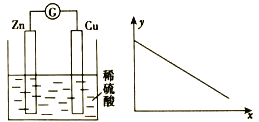
A. 铜棒的质量 B. c(H+) C. c(SO42-) D. C(Zn2+)
难度: 中等查看答案及解析
-
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )
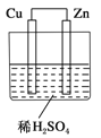
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e-==Cu2+,发生氧化反应
A. ①②③ B. ②④ C. ②③④ D. ③④⑤⑥
难度: 简单查看答案及解析
-
根据下列反应事实:①A+B2+===A2++B ②D+2H2O===D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-===E,B-2e-===B2+。由此可知下列微粒的关系正确的是
A. 还原性:D>E>A>B B. 还原性:A>B>D>E
C. 氧化性:D2+>E2+>A2+>B2+ D. 氧化性:E2+>B2+>A2+>D2+
难度: 中等查看答案及解析
-
某太阳能电池的工作原理如图所示。下列说法正确的是( )
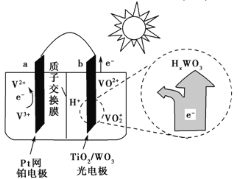
A. 光照时,b极的电极反应式为VO2+-e-+H2O===VO2++2H+
B. 光照时,每转移2 mol电子,有2 mol H+由a极区经质子交换膜向b极区迁移
C. 夜间,a极的电极反应式为V3++e-===V2+
D. 硅太阳能电池供电原理与该电池相同
难度: 中等查看答案及解析
-
某研究性学习小组欲完成反应:2HC1+Cu=CuCl2+H2↑,设计了下列四个实验,你认为可行的是( )
A.
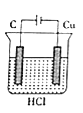
B.
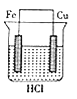
C.

D.
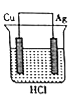
难度: 中等查看答案及解析
-
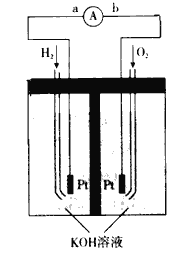
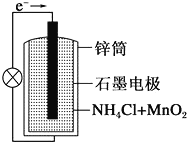
某电化学气敏传感器的工作原理如图所示.下列说法正确的是( )
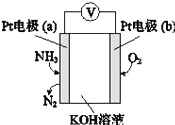
A. b极为负极
B. a极的电极反应式为2NH3+3O2﹣﹣6e﹣═N2+3H2O
C. 反应消耗的NH3与O2的物质的量之比为4:5
D. 该传感器在工作过程中KOH的物质的量不变
难度: 中等查看答案及解析
-
下列叙述正确的是
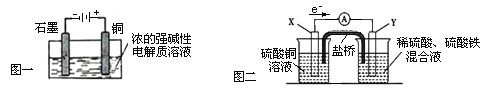
A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应
B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成
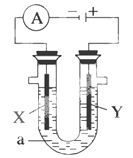
C.图二装置中发生:Cu+2Fe3+ = Cu2+ +2Fe2+ ,X极是负极,Y极材料可以是铜
D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+ 经过盐桥进入左侧烧杯中
难度: 中等查看答案及解析
 N2
N2