-
化工生产与人类进步紧密相联。下列有关说法不正确的是
A. 空气吹出法提取海水中溴通常使用SO2作还原剂
B. 侯氏制碱法工艺流程中利用了物质溶解度的差异
C. 合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D. 工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述不正确的是
A. 常温常压下,1 mol氦气中含有的质子数为2NA
B. l0g46%乙醇水溶液中所含氧原子数为0.4NA
C. 1 Ll mol/LNa2CO3溶液中,阴离子总数小于NA
D. 浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
难度: 中等查看答案及解析
-
环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是

A. n分子中所有原子都在同一个平面上
B. n和:CBr2生成p的反应属于加成反应
C. p分子中极性键和非极性键数目之比为2:9
D. m分子同分异构体中属于芳香族化合物的共有四种
难度: 中等查看答案及解析
-
下列有关实验能达到相应实验目的的是
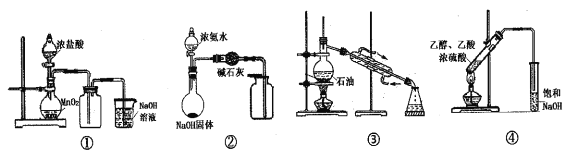
A. 实验①用于实验室制备氯气 B. 实验②用于制备干燥的氨气
C. 实验③用于石油分馏制备汽油 D. 实验④用于制备乙酸乙酯
难度: 中等查看答案及解析
-
如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是
A. X、Y、W三种元素最低价氢化物的沸点依次升高
B. Z、X、W三种元素氧化物对应水化物的酸性依次增强
C. 由X、W和氢三种元素形成的化合物中只含共价键
D. X、Z形成的二元化合物是一种新型无机非金属材料
难度: 中等查看答案及解析
-
下列有关电化学原理及应用的相关说法正确的是
A. 电池是能量高效转化装置,燃料电池放电时化学能全部转化为电能
B. 电热水器用牺牲阳极的阴极保护法阻止不锈钢内胆腐蚀,阳极选用铜棒
C. 工业上用电解法精炼铜过程中,阳极质量减少和阴极质量增加相同
D. 电解氧化法在铝制品表面形成氧化膜减缓腐蚀,铝件作为阳极
难度: 中等查看答案及解析
-
25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是
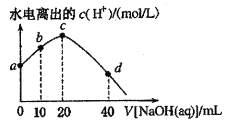
A. a点溶液中:c(H+)=6.0
10-3mol
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
难度: 中等查看答案及解析



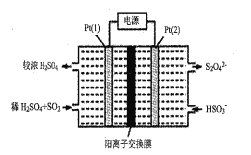
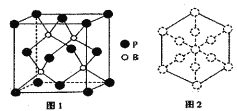
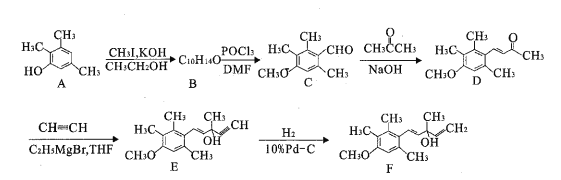
 的合成路线流程图:__________
的合成路线流程图:__________