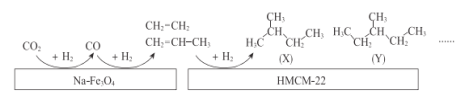
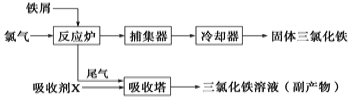
-
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小的排列顺序正确的是( )
甲:500 ℃,10 mol SO2和5 mol O2反应 乙:500 ℃,V2O5作催化剂,10 mol SO2和5 mol O2反应
丙:450 ℃,8 mol SO2和5 mol O2反应 丁:500 ℃,8 mol SO2和5 mol O2反应
A. 甲、乙、丙、丁 B. 乙、甲、丙、丁
C. 丁、丙、乙、甲 D. 乙、甲、丁、丙
难度: 简单查看答案及解析
-
利用CH4和O2的反应,在KOH溶液中用铂作电极可以构成原电池。下列说法正确的是
①每消耗1molCH4可以向外电路提供8mole-
②在负极上O2获得电子,电极反应式为O2+2H2O+4e-=4OH-
③外电路电子由负极流向正极,内电路电子由正极流向负极
④电池放电过程中,溶液的pH不断降低
⑤负极发生氧化反应,正极发生还原反应
⑥负极附近会出现淡蓝色火焰
A. ①④⑤ B. ①③④ C. ②③⑥ D. ②⑤⑥
难度: 中等查看答案及解析
-
下列性质的比较,不能用元素周期律解释的是
A. 原子半径:S>Cl
B. 热稳定性:Na2CO3>NaHCO3
C. 还原性:I﹣>Br﹣
D. 酸性:H2SO4>H3PO4
难度: 中等查看答案及解析
-
下列事实可以用氢键解释的是
A. I2易溶于CCl4,难溶于水 B. HCl、HBr、HI的热稳定性依次减弱
C. CH4、C2H6、C3H8的熔、沸点依次升高 D. 水结成冰体积膨胀,密度变小
难度: 中等查看答案及解析
-
下列说法正确的是
A. H2、D2和T2互称为同素异形体
B.
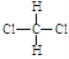 和
和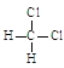 互称为同分异构体
互称为同分异构体C. 35Cl和37Cl 互称为同位素
D. CH3−CH3和CH3−CH=CH2互称为同系物
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A. NH3的结构式:
B. 16667Ho的原子核内的中子数与核外电子数之差是32
C. Na2O2与H2O2中所含的化学键类型不完全相同
D. 可以利用在水溶液中是否导电证明氯化铝是离子化合物还是共价化合物
难度: 简单查看答案及解析
-
下列烷烃在光照条件下与氯气反应,能生成两种一氯代烃的是( )
A. CH3CH2CH2CH3 B. CH3 CH2CH(CH3)CH3
C. C(CH3)4 D. CH3CH(CH3)CH2CH3
难度: 中等查看答案及解析
-
下列各组物质中化学键的类型相同的是( )
A. HCl、MgCl2、NH4Cl B. NH3、H2O、CO2
C. CO、Na2O、CS2 D. CaCl2、NaOH、N2O
难度: 简单查看答案及解析
-
一定温度下,可逆反应2NO2(g)
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
A. ①④⑤⑥ B. ①③④⑥ C. ①②③⑤ D. ②⑤⑥
难度: 中等查看答案及解析
-
已知H2(g)+2ICl(g)
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
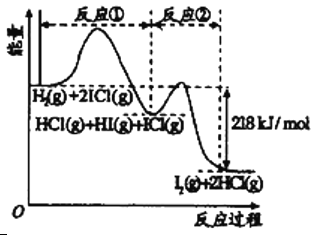
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与图中相应峰高有关
D. HI(g)+ICl(g)
I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
难度: 中等查看答案及解析
-
锂-空气电池原理模型如图所示,下列说法不正确的是
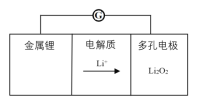
A. 电池正极可以吸附空气中氧气作为氧化剂
B. 正极反应为2Li+ + O2 + 2e-
Li2O2
C. 电解质能传递锂离子和电子,不可以用水溶液
D. 负极反应Li - e-=Li+
难度: 中等查看答案及解析
-
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O===2Ag+Zn(OH)2,下列说法中不正确的是
A. 原电池放电时,负极上发生反应的物质是Zn
B. 负极发生的反应是Zn+2OH−−2e−===Zn(OH)2
C. 工作时,负极区溶液c(OH−)减小
D. 溶液中OH−向正极移动,K+、H+向负极移动
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c0(X)、c0(Y)、c0(Z)(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c0(X)∶c0(Y)=3∶1
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等
D. c0(X)的取值范围为0 mol·L-1<c0(X)<0.14 mol·L-1
难度: 中等查看答案及解析
-
已知2H2(g)+ O2(g) = 2H2O(g),H—H、O=O和O—H键的键能分别为436 kJ·mol-1、496kJ·mol-1和462 kJ·mol-1,则2g H2完全燃烧放出的热量为
A. 480 kJ B. 240 kJ C. 960 kJ D. 916 kJ
难度: 中等查看答案及解析
-
1mol某烷烃完全燃烧消耗的O2为11 mol,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有( )
A. 3种 B. 6种 C. 5种 D. 7种
难度: 中等查看答案及解析