-
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A. 甲醇 B. 天然气 C. 液化石油气 D. 氢气
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 中子数为10的氧原子:108O B. Mg2+的结构示意图:
C. 硫化钠的电子式:
D. 甲烷的比例模型:
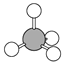
难度: 中等查看答案及解析
-
下列性质中,可以证明某化合物内一定存在离子键的是( )
A. 水溶液能导电 B. 由金属和非金属元素的原子组成
C. 熔融状态能导电 D. 可以溶于水
难度: 中等查看答案及解析
-
短周期主族元素X、Y、A、B、C在元素周期表的位置如图所示,A是非金属性最强的元素,则下列说法不正确的是( )
X
A
Y
C
B
A. 原子半径由小到大的顺序为A<B<C<Y
B. B、C简单离子半径:C2-<B-
C. X、Y最高价氧化物对应的水化物的酸性由弱到强的顺序为H2YO3<H2XO3
D. B、C简单离子的还原性由弱到强的顺序为B-<C2-
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. 某些花岗石产生氡(22288Rn),该元素的相对原子质量为222
B. Se是人体必需的微量元素, 7834Se和8034Se互为同位素
C. F2通入氯化钠溶液中,生成的主要气体为O2
D. 136CNMR(核磁共振)可用于含碳化合物的结构分析,
C的中子数为7
难度: 中等查看答案及解析
-
下列变化一定为放热的化学反应的是( )
A. H2O(g)=H2O(l)放出44 kJ热量
B. ΔH > 0的化学反应
C. 形成化学键时共放出862 kJ能量的化学反应
D. 能量变化如图所示的化学反应

难度: 中等查看答案及解析
-
B元素最高价氧化物对应的水化物为H2BO4,则它对应的气态氢化物的化学式为( )
A. HB B. H2B C. BH4 D. BH3
难度: 中等查看答案及解析
-
如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
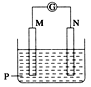
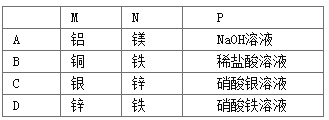
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 在101 kPa时,1 mol S(s)和2 mol S(s)的燃烧热相等
B. 需要加热才能发生的反应一定是吸热反应
C. 已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热ΔH > 2×(-57.3) kJ·mol-1
D. 已知2C(s)+2O2(g)===2CO2(g) ΔH=a kJ·mol-1;2C(s)+O2(g)===2CO(g) ΔH=b kJ·mol-1;则b>0>a
难度: 中等查看答案及解析
-
下列有关化学反应与能量的说法中错误的是( )
A. 化学反应必然伴随着能量变化
B. 油脂在人体中氧化是放热反应
C. 镁与盐酸反应是吸热反应
D. 氢分子(H-H)变成2个H需吸收能量
难度: 中等查看答案及解析
-
下列事实能证明甲烷分子是以碳原子为中心的正四面体结构的是( )
A. 四个C-H键完全相同 B. CH4的一氯代物只有一种
C. 在常温常压下CH2Cl2为液体 D. CH2Cl2只有一种空间结构
难度: 简单查看答案及解析
-
下列关于元素的叙述正确的是( )
A. 在周期表中金属与非金属的分界处可以找到催化剂
B. 只有在原子中,质子数才与核外电子数相等
C. 目前使用的元素周期表中,包含元素种类最多的族是第ⅢB族
D. 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是( )
A. 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多
B. 氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
C. Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D. 已知中和反应的反应热ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ
难度: 中等查看答案及解析
-
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,Na2O2(s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-226 kJ·mol-1,根据以上热化学方程式判断,下列说法正确的是( )。
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
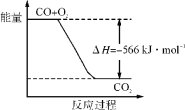
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,转移电子数为6.02×1023
难度: 中等查看答案及解析
-
根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号
L
M
Q
R
T
原子半径/nm
0.152
0.143
0.160
0.102
0.074
主要化合价
+1
+3
+2
+6、-2
-2
请判断以下叙述正确的是( )
A. 氢化物的沸点为H2T<H2R
B. L+与T2-的核外电子数相等
C. 单质L在空气中燃烧生成的氧化物中,氧元素化合价为-1价
D. M与T形成的二元化合物具有两性
难度: 中等查看答案及解析
-
锂空气电池放电时的工作原理如图所示。下列叙述正确的是( )
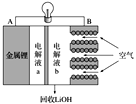
A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2O===4LiOH
C. B电极反应式为O2+4H++4e-===2H2O
D. 电解液a可以为氯化锂溶液
难度: 中等查看答案及解析
-
下列有关物质结构和化学用语的说法正确的是( )
A. 39 g Na2O2晶体中所含阴、阳离子总数为2NA
B. 1个氮气分子中存在3对共用电子对
C. NaOH和Na2O中所含的化学键类型完全相同
D. AlCl3和MgF2中都含有共价键
难度: 中等查看答案及解析
-
下列各组变化中,前者是放热反应,后者是吸热反应的是( )
A. 生石灰溶于水;锌粒和稀硫酸反应
B. 干冰升华;金属或金属氧化物熔化
C. 氨水与醋酸反应;碳和水蒸气反应生成CO和H2
D. 工业煅烧石灰石;化石燃料燃烧
难度: 中等查看答案及解析
-
下列关于化学键的说法中正确的是( )
A. H2O2中既有极性键又有非极性键
B. 阴、阳离子间通过静电引力而形成的化学键叫做离子键
C. 非金属元素之间只能形成共价化合物
D. 所有盐、碱和金属氧化物中都含有离子键
难度: 中等查看答案及解析
-
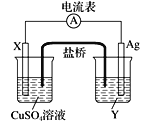
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。 下列说法正确的是 ( )
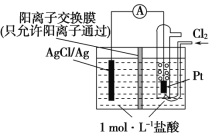
A. 正极反应为AgCl+e-=Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.02 mol e- 时,交换膜左侧溶液中约减少0.04 mol离子
难度: 中等查看答案及解析
-
下列有关电池的说法不正确的是( )
A. 手机上用的锂离子电池属于二次电池
B. 铜锌原电池工作时,电子沿溶液从铜电极流向锌电极
C. 燃料电池的能量转换率超过80%
D. 锌锰干电池中,锌电极是负极
难度: 中等查看答案及解析
-
如图中,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
A. 元素b位于第ⅥA族,有+6、-2两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c > d
D. 元素c和e的气态氢化物的稳定性:c > e
难度: 困难查看答案及解析
-
关于下图所示的原电池,下列说法正确的是( )
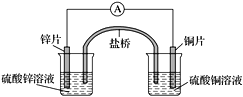
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
难度: 中等查看答案及解析
-
a、b、c、d均大于0,下列表示物质燃烧热的热化学方程式的是( )
A. 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-a kJ·mol-1
B. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
C. 2CO(g)+O2(g)=2CO2(g) ΔH=-c kJ·mol-1
D. 2CH3CH2OH(l)+O2(g)=2CH3CHO(l)+2H2O(l) ΔH=-d kJ·mol-1
难度: 中等查看答案及解析
-
在测定中和热的实验中,下列说法正确的是( )
A. 使用环形玻璃搅拌棒是为了增大反应速率,减小实验误差
B. 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C. 用50 mL 0.55 mol·L-1的NaOH溶液与60 mL 0.50 mol·L-1的盐酸反应,测得的中和热数值偏大
D. 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、酒精灯、温度计
难度: 中等查看答案及解析