-
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是
① I2 + SO2 + 2H2O = H2SO4 + 2HI;
② 2FeCl2 + Cl2 = 2FeCl3;
③ 2FeCl3 + 2HI = 2FeCl2 + 2HCl +I2
A.SO2>I->Fe2+>Cl- B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.I->Fe2+>Cl->SO2
难度: 中等查看答案及解析
-
下列物质组合中,既能和强酸反应又能和强碱反应的化合物是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3
A.①②③④ B.②③④ C.①③④ D.①②③
难度: 简单查看答案及解析
-
下列物质,受热后不能分解的是( )
A.NaOH B.Fe(OH)3 C.Al(OH)3 D.NaHCO3
难度: 简单查看答案及解析
-
下列各组中的两物质作用时,如果反应条件或反应物用量改变,对生成物没有影响的是( )
A.Na与O2 B.Na2O2与CO2 C.Fe与O2 D.AlCl3溶液与NaOH溶液
难度: 简单查看答案及解析
-
能使FeSO4与KSCN混合溶液变为红色的试剂是
A.稀硫酸 B.新制氯水 C.硝酸银溶液 D.澄清石灰水
难度: 简单查看答案及解析
-
下列反应的离子方程式中,书写正确的是
A.铝投入氢氧化钠溶液中:Al + 2OH-=AlO2-+ H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.FeCl3溶液跟NaOH反应:Fe3++3OH-=Fe(OH)3↓
D.用FeCl3溶液腐蚀铜线路板:Cu +Fe3+ = Cu2+ +Fe2+
难度: 简单查看答案及解析
-
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
A.所用NaOH已吸潮
B.配制溶液时容量瓶中残留少量蒸馏水
C.有少量NaOH溶液残留在烧杯内
D.向容量瓶加水时眼睛一直俯视液面
难度: 简单查看答案及解析
-
通过对金属钠与水反应现象的观察,不能得出的结论是
A.金属钠导电性强 B.金属钠密度比水小
C.金属钠熔点低 D.金属钠化学性质活泼
难度: 简单查看答案及解析
-
在无色透明的溶液中,能大量共存的离子组是
A.Na+、Mg2+、H+、OH- B.H+、Al3+、AlO2-、CO32-
C.H+、Fe3+、Cl-、SiO32- D.K+、Ca2+、NO3-、HCO3-
难度: 简单查看答案及解析
-
下列溶液的c(Cl-)与50 mL 1 mol·L-1的AlCl3溶液c(Cl-)相等的是( )
A.150 mL 1 mol·L-1的NaCl B.75 mL 3 mol·L-1的NH4Cl
C.75 mL 2 mol·L-1的MgCl2 D.100 mL 2mol·L-1的FeCl3
难度: 简单查看答案及解析
-
要将NaCl溶液中含有的少量FeCl3、AlCl3杂质除去,合理的方案是( )
A.加入过量氨水后过滤
B.加入过量NaOH溶液后过滤
C.先加过量NaOH溶液后过滤,取滤液再通入足量CO2再过滤
D.先加过量NaOH溶液后过滤,取滤液通入足量CO2再过滤,往滤液中加入适量盐酸
难度: 中等查看答案及解析
-
用
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氮原子的氮气在标准状况下的体积约为22.4L
B.标准状况下,11.2L
含有的分子数为0.5NA
C.在常温常压下,11.2 L
含有的分子数为0.5NA
D.
和
的混合物,所含氧原子数为0.2NA
难度: 中等查看答案及解析
-
将某份铁铝合金样品均分为两份,一份加入足量稀硫酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为( )
A.3∶2 B.2∶1 C.3∶4 D.4∶3
难度: 中等查看答案及解析
-
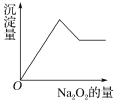
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为

A.2∶1 B.4∶1 C.1∶1 D.1∶2
难度: 中等查看答案及解析