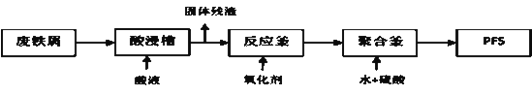
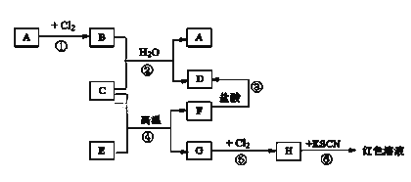
-
关于钠的描述正确的是 ( )
①钠在自然界既有游离态又有化合态存在
②金属钠着火可以用泡沫灭火器救火
③碳酸钠性质稳定,可治疗胃酸过多
④Na-K合金做原子反应堆的导热剂
⑤钠比铜活泼,因而钠可以从CuCl2溶液中置换出铜
⑥过氧化钠是淡黄色固体,可作漂白剂
A.①②⑤ B.④⑥ C.③④ D.②③④
难度: 中等查看答案及解析
-
下列不能通过单质间反应而制得的物质是( )
A.CuCl2 B.CuS C.FeCl3 D.FeS
难度: 中等查看答案及解析
-
为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.KSCN溶液 B.铁片 C.HCl溶液 D.石蕊溶液
难度: 简单查看答案及解析
-
加热熔化氢氧化钠的坩埚,应选用的是( )
A.瓷坩埚 B.石英坩埚 C.铁坩埚 D.铝坩埚
难度: 简单查看答案及解析
-
用含有少量镁的铝片制取纯净的Al(OH)3,可能有的步骤为:① 加盐酸溶解;② 加过量苛性钠溶液;③ 过滤;④ 通入过量CO2;⑤ 加过量纯碱溶液,实验操作最合理的组合及顺序是
A.①⑤④③ B.②③④③ C.②③⑤③ D.①⑤③
难度: 中等查看答案及解析
-
钠,镁,铝,铁四种金属组成的混合物6 g,与足量的稀硫酸反应,产生标准状况下的氢气6.72 L,由此判断混合物中必含 ( )
A.钠 B.镁 C.铝 D.铁
难度: 中等查看答案及解析
-
通过量CO2于下列溶液中,出现浑浊的是
A.Ba(NO3)2溶液 B.澄清石灰水
C.Na2SiO3溶液 D.饱和NaHCO3溶液
难度: 中等查看答案及解析
-
下列关于合金的说法正确的是 ( )
①合金至少含两种金属
②合金中元素以化合物形式存在
③合金中一定含金属
④合金一定是混合物
⑤铁锈是一种铁合金
A.①② B.②③⑤ C.③④ D.③
难度: 简单查看答案及解析
-
CaCl2和NaCl组成的混合溶液中,c(Ca2+): c(Na+)=1 : 2,若该溶液中共有6mol Cl-,则混合溶液中NaCl的物质的量为( )
A.1mol B.2mol C.3mol D.4mol
难度: 简单查看答案及解析
-
下列除杂质的方法不正确的是 ( )
A.铜粉中混有铁粉:加入过量盐酸充分反应,过滤
B.FeCl2溶液中混有少量FeCl3:加入Fe粉,过滤
C.NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体
D.CO2中混有HCl:将其通入Na2CO3溶液,洗气
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol SiO2中含有Si-O键为4NA
B.1 mol氢氧化铁胶粒所含氢氧化铁的分子数为NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D.足量的Fe和1mol Cl2完全反应,转移的电子数为3NA
难度: 中等查看答案及解析
-
下列实验过程能引起结果偏高的是 ( )
①配制100gl0%CuSO4溶液,称取l0g硫酸铜晶体溶于90g水中
②测定硫酸铜晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的硫酸溶液时,定容时俯视容量瓶的刻度线
④质量分数为10%和90%的两种硫酸等质量混合配制50%的硫酸溶液
A.①④ B.②④ C.②③ D.②③④
难度: 中等查看答案及解析
-
下列各组物质只用胶头滴管和试管不能鉴别的是
A.KOH溶液与AlCl3溶液 B.MgCl2溶液与氨水
C.NaAlO2溶液与盐酸 D.Na2CO3溶液与盐酸
难度: 中等查看答案及解析
-
既能与酸(H+)反应,又能与碱(OH-)反应的化合物是 ( )
①MgO ②Al(OH)3 ③NaHSO4 ④NaHCO3 ⑤CH3COONH4 ⑥Al
A.②④ B.②③④ C.②④⑤ D.②④⑥
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+H2O
B.向含有0.4 mol FeI2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2I﹣+3Cl2=4Fe3++6Cl﹣+I2
C.Ca(OH)2溶液中通入足量的CO2:CO2+ OH﹣= HCO3﹣
D.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3﹣=3Fe3++NO↑+4H2O
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.pH=12的溶液:K+、Na+、CH3COO-、Br-
B.红色石蕊的溶液:NH4+、Ba2+、AlO2-、Cl-
C.1.0mol▪L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
a
b
c
A
Al2O3
AlCl3
Al(OH)3
B
Na
Na2O
Na2O2
C
Si
SiO2
H2SiO3
D
Fe
FeCl2
FeCl3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中大量存在的离子有( )种
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4=4NaMnO4+5Bi(SO4)3+3Na2SO4+□,下列说法不正确的是( )
A.“□”内的物质为水,配平系数为14 B.若生成1mol NaMnO4,则转移5mole-
C.反应方程式中的硫酸可换为盐酸 D.溶液中有Mn2+的现象是溶液变为紫红色
难度: 中等查看答案及解析
-
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是
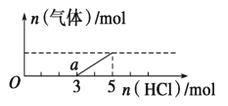
A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.a点溶液中c (HCO3-) >c (CO32-)
C.标准状况下,通入CO2的体积为44.8L
D.原NaOH溶液的物质的量浓度为5mol/L
难度: 中等查看答案及解析