-
以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)
CuOH(s)+Cl-(aq)+H+(aq)。
该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____________。
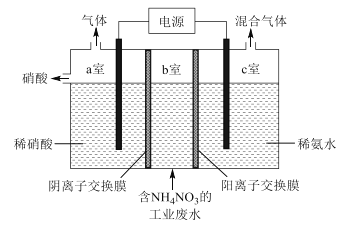
(2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。
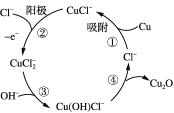
①阳极(反应②)的电极反应式为________________________________。
②电解一段时间后,电解液补充一定量的__________可完全恢复成原电解质溶液(填化学式)。
③溶液中③、④二步总反应的离子方程式为____________________________________。
(3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)
CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
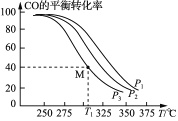
①该反应的ΔH_____0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是__________;
②起始时,甲容器中c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为______(保留三位有效数字)。起始时,乙容器中c(H2)=0.40 mol·L-1,c(CO)=0.20 mol·L-1,T1℃下反应达到平衡,CO的平衡转化率______(填字母)。
A.大于40% B.小于40% C.等于40% D.等于80%
难度: 困难查看答案及解析
-
氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为_______________ ,Cr位于元素周期表第四周期____族。
(2)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K___Cr(填“<”或“>”);
(3)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为______________。
(4)Cr的一种配合物结构如图所示:
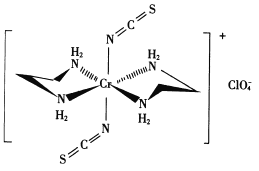
①阴离子C1O4-的空间构型为___________形。
②配离子中,中心离子的配位数为________。
(5)配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是_____________,分子中三种元素电负性从大到小的顺序为________________。
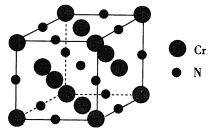
(6)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5.9 g·cm-3,阿伏加德罗常数的值为6.02×1023,则氮化铬的晶胞边长为_________________nm(列出计算式).
难度: 中等查看答案及解析
-
美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:
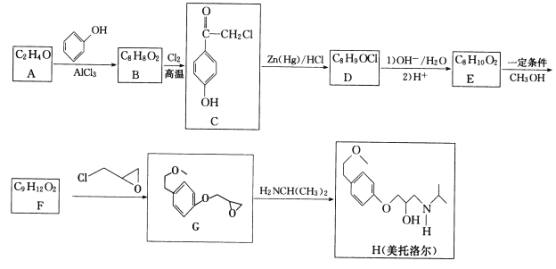
已知:①CH3COCH2R
CH3CH2CH2R
② B- F苯环上均只有两个取代基
回答下列问题:
(1)A的化学名称是___,C中含氧官能团的名称是___
(2)E→F的反应类型是___,G的分子式为___。
(3)D的结构简式为___。
(4)反应B→C的化学方程式为___
(5)芳香族化合物W是G的同分异构体,W能发生水解反应,核磁共振氢谱有4组峰,峰面积之比为9:3:2:2,写出一种符合要求的W的结构简式:___.
(6)4一苄基苯酚(
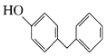 )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。难度: 中等查看答案及解析