-
以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l) CuOH(s)+Cl-(aq)+H+(aq)。
CuOH(s)+Cl-(aq)+H+(aq)。
该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____________。
(2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。
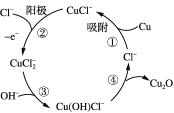
①阳极(反应②)的电极反应式为________________________________。
②电解一段时间后,电解液补充一定量的__________可完全恢复成原电解质溶液(填化学式)。
③溶液中③、④二步总反应的离子方程式为____________________________________。
(3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g) CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
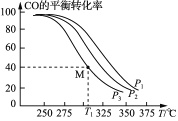
①该反应的ΔH_____0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是__________;
②起始时,甲容器中c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为______(保留三位有效数字)。起始时,乙容器中c(H2)=0.40 mol·L-1,c(CO)=0.20 mol·L-1,T1℃下反应达到平衡,CO的平衡转化率______(填字母)。
A.大于40% B.小于40% C.等于40% D.等于80%
-
CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并验证其它分解产物。
(查阅资料)
①
②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
(1)配平潮湿CuCl在空气中被氧化的化学方程式:
____CuCl+_____O2+_____ ===3CuO·CuCl2·3H2O+______HCl
(实验探究)该小组选用下图装置进行实验(夹持加热仪器略)。
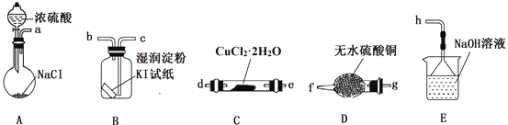
(2)装置A用于制取HCl:NaCl+H2SO4===NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和_________性;
(3)按实验要求选择上图装置,连接顺序为:a____________(按气流方向,用小写字母表示);
(4)根据完整的实验装置进行实验,实验步骤如下:
①连接装置,________________;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;步骤④通HCl的目的是______________________;
(5)装置E中发生反应的离子方程式是______________________________。
(实验分析与改进)
(6)装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:__________________________________
(7)反应结束后,CuCl产品中可能含有少量未分解的CuCl2,乙同学认为只用一种日常生活常见的液体即可检验。该实验方案为:取少量固体放入小试管中,_________________________________。
-
CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并验证其它分解产物。
【查阅资料】
①
②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
⑴配平潮湿CuCl在空气中被氧化的化学方程式_________
____CuCl+_____O2+_____□=_______3CuO·CuCl2·3H2O+______HCl
【实验探究】该小组选用下图装置进行实验(夹持加热仪器略)。

⑵装置A用于制取HCl:NaCl+H2SO4=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和_________性;
⑶按实验要求选择上图装置,连接顺序为:a_______(按气流方向,用小写字母表示);
⑷根据完整的实验装置进行实验,实验步骤如下:
①连接装置,_______;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;…
步骤①是__________________;步骤④通HCl的目的是_________________;
⑸装置E中发生反应的离子方程式是______________________。
【实验分析与改进】
⑹装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:_____________________
⑺反应结束后,CuCl产品中可能含有少量未分解的CuCl2,乙同学认为只用一种日常生活常见的液体即可检验。该实验方案为:取少量固体放入小试管中,_________________。
-
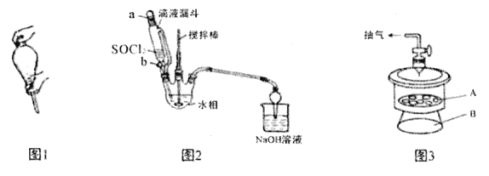
氯化亚铜是用途广泛的铜盐产品。CuCl晶体呈白色,微溶于水,不溶于乙醇和稀盐酸,溶于浓盐酸,见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl晶体,设计如下制备流程:
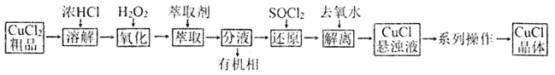
实验涉及的操作及装置如下:
已知
①在较浓的盐酸溶液中:
a.Cu2+主要以[CuCl4]2-(呈黄色)形式存在
b.Fe3+能溶解于萃取剂一甲基异丁基甲酮(无色透明液体,密度为0.8g/cm3)
②CuCl在溶液中存在络合与解离平衡:CuCl(s)+3Cl-(aq) [CuCl4]3-(aq无色)
[CuCl4]3-(aq无色)
③SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成SO2和HCl气体
请回答:
(1)下列有关CuCl2提纯操作正确的是______
A.将氧化液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞,用力振摇(见上图1)
B.经几次振摇并打开上口玻璃塞放气后,将分液漏斗置于铁架台的铁圈上,静置片刻
C.Fe2+经氧化、萃取、分液,进入有机相除去
D.取分液后的水相少许,滴入KSCN溶液检验萃取是否完全
(2)还原反应装置如上图2所示:
①向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞_____(填“a”、“b”或“a和b”)。
②水相中[CuCl4]2-被SOCl2还原为[CuCl4]3-的离子方程式为______。
③判断反应完成的实验现象是________________。
(3)向混合液中加入大量去氧水能得到CuC1悬浊液的原因是___________
(4)“系列操作”包括:抽滤→洗涤→干燥。下列说法不正确的是__________
A.抽滤操作用到的器材包括滤纸、布氏漏斗、吸滤瓶、安全瓶和抽气泵等
B.可选用无水乙醇洗涤CuCl,洗涤时应关闭水龙头,使洗涤剂缓慢通过沉淀物
C.取最后一次洗涤液,滴加BaCl2溶液,若无白色沉淀产生,则证明产品已洗净
D.在避光下产品应置于A处真空干燥(上图3)
-
氯化亚铜是化工和印染等行业的重要原料,广泛用作有机合成的催化剂。
Ⅰ.甲采用CuCl2·2H2O热分解法制备CuCl,装置如图。
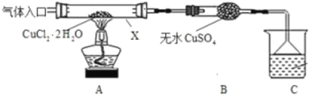
(1)仪器X的名称是_______________,C中烧杯的试剂可以是__________。
(2)“气体入口”通入的气体是_______。
(3)反应结束后,取所得产品分析,发现其中含有氧化铜,其可能原因是______________。
Ⅱ.乙另取纯净CuCl2固体用如下方法制备CuCl。

(4)操作②中反应的离子方程式为___________________。
(5)操作①中若用100 mL 10 mol/L盐酸代替0.2 mol/L盐酸,再通入SO2后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:c(H+)过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、100 mL0.2 mol/L盐酸及________mL10.0mol/LH2SO4配制成200 mL溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:_______________。请设计实验说明该猜想是否成立:_________________。
-
氯化亚铜是化工和印染等行业的重要原料,广泛用作有机合成的催化剂。
Ⅰ.甲采用CuCl2·2H2O热分解法制备CuCl,装置如图。
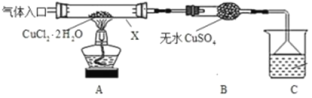
(1)仪器X的名称是_______________,C中烧杯的试剂可以是__________。
(2)“气体入口”通入的气体是_______。
(3)反应结束后,取所得产品分析,发现其中含有氧化铜,其可能原因是______________。
Ⅱ.乙另取纯净CuCl2固体用如下方法制备CuCl。

(4)操作②中反应的离子方程式为___________________。
(5)操作①中若用100 mL 10 mol/L盐酸代替0.2 mol/L盐酸,再通入SO2后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:c(H+)过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、100 mL0.2 mol/L盐酸及________mL10.0mol/LH2SO4配制成200 mL溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:_______________。请设计实验说明该猜想是否成立:_________________。
-
铜及其化合物有广泛的应用。氯化亚铜(CuCl)微溶于水,不溶于酒精,在潮湿空气中易水解氧化。某课外小组以某工业废渣(主要成分为硅、铜、碳等)为原料制备CuCl的流程示意图如图所示。

(1)“滤渣”的主要成分为______(填化学式)。
(2)“还原”过程中Cu2+还原为CuCl,请写出反应的离子方程式:_________。
(3)还原过程中加入的Na2SO3过量,目的是除去氧气防止CuCl被氧化,原理是______(用化学方程式表示)。
(4)CuCl在潮湿的环境中容易被氧化生成Cu2(OH)3Cl,反应化学方程式是__________。
(5)CuCl粗品中含有Cu2+加入铜粉和盐酸,Cu2+转化为CuCl,反应的离子方程式是__________,操作Ⅲ中包括对滤饼的醇洗,醇洗的目的是_________。
(6)CuCl在含有Cl-的溶液中存在平衡:CuCl+2Cl- [CuCl3]2-,加水稀释,Cl-浓度__________(填写“变大”、“变小”或“”不变)。
[CuCl3]2-,加水稀释,Cl-浓度__________(填写“变大”、“变小”或“”不变)。
-
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业.CuCl 难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu 和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl 的工艺过程如下:
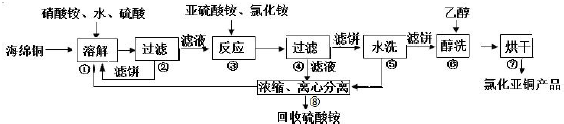
回答下列问题:
(1)步骤①中真正的氧化剂是___________,溶解温度应控制在60-70 度,原因是___________;
(2)写出步骤③中主要反应的离子方程式是___________;
(3)步骤⑧是分离滤液和洗涤液操作,实验室里混有杂质NaCl 的(NH4)2SO4 固体提纯的方法是___________;
(4)上述工艺中,步骤⑥不能省略,理由是___________;
(5)步骤②、④、⑤、⑧都要进行固液分离.工业上常用的固液分离设备有___________(填字母).
A、离心机B、分馏塔C、框式压滤机D、反应釜
(6)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3 溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L 的K2Cr2O7 溶液滴定到终点,消耗K2Cr2O7 溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl 的质量分数为___________。
-
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
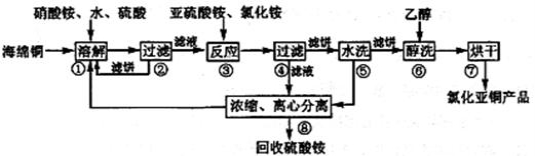
回答下列问题:
(1)写出“溶解”过程中发生的氧化还原反应的离子方程式(N元素被还原到最低价):_______,溶解温度应控制在60-70℃,原因是_______。
(2)写出步骤③中,氧化剂与还原剂的物质的量之比为________。已知NH4Cl、Cu2+的物质的量之比[n(NH4Cl)/n(Cu2+)]与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定程度后的氯化亚铜的沉淀率减少,其可能的原因是__________。

(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____(写名称),回收的主要物质是____(写化学式)
(4)上述工艺中,步骤⑥醇洗的作用是__________。
(5)称取2.000g CuCl样品(杂质不参与反应),溶于一定量的0.5000mol/L FeCl3溶液中,加水稀释至200mL得到溶于,取20.00mL用0.1000mol/L的Ce(SO4)2溶液滴定到终点,消耗20.00mL Ce(SO4)2
有关反应式:Fe3++CuCl═Fe2++Cu2++Cl﹣ Ce4++Fe2+═Fe3++Ce3+
则样品中CuCl的质量分数_________。
-
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中氧化还原反应的离子方程式为__________,溶解温度应控制在60~70℃,原因是______。
(2)写出步骤③中主要反应的离子方程式__________。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是__________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是__________。
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amoI/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+。样品中CuCl的质量分数为________。
CuOH(s)+Cl-(aq)+H+(aq)。

CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。















