-
水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.氨水的电离程度 B.c(NH3·H2O)/c(OH-)
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
难度: 中等查看答案及解析
-
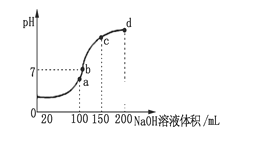
25℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入NaOH溶液体积变化如图。下列说法不正确的是
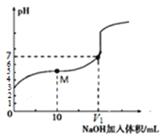
A. HX为弱酸
B. V1 <20
C. M点溶液中离子浓度由大到小的顺序为:c(X-)>c(Na+)>c(H+)>c(OH-)
D. 二者等体积混合时,c(Na+)=c(X-) + c(OH-)
难度: 中等查看答案及解析
-
下列各离子方程式中,属于水解反应的是( )
A.HCO3-+H2O
H3O++CO32- B.NH4++H2O
NH3·H2O+H+
C.S2-+2H2O
H2S+2OH- D.H2O+H2O
H3O++OH-
难度: 简单查看答案及解析
-
常温下,0.1mol/L 的下列溶液中,c(NH4+)最大的是( )
A.NH4Cl B.(NH4)2Fe(SO4)2 C.(NH4)2CO3 D.CH3COONH4
难度: 困难查看答案及解析
-
下列说法不正确的是
A.MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能
B.向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动
C.将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深,这一事实可以用勒夏特列原理解释
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
难度: 中等查看答案及解析
-
经测定,某溶液中只含有NH4+、Cl-、H+、OH- 四种离子,下列说法中错误的是
A.溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中的溶质是NH4Cl 和NH3•H2O,则离子间可能满足:c(NH4+)> c(Cl-)> c(OH-)> c(H+)
C.若溶液中四种离子满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl
D.若溶液中c(Cl-)=c(NH4+),则该溶液一定呈中性
难度: 中等查看答案及解析
-
已知:①2CO2(g)+4H2(g)═2CH3OH(g)+O2(g) △H=+385.8kJ/mol
②2H2(g)+O2(g)═2H2O(l) △H=−571.6kJ/mol,则CH3OH(g) +
O2(g)═CO2(g)+2H2O(l)的△H为( )
A. +478.7kJ/mol B. −764.5 kJ/mol C. −478.7kJ/mol D. +764.5kJ/mol
难度: 中等查看答案及解析
-
已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的
气体,且起始时体积相同。发生反应:
.一段时间后相继达到平衡状态下列说法中正确的是( )
甲
 乙
乙A.平衡时
体积分数:甲<乙
B.达到平衡所需时间,甲与乙相等
C.该反应的平衡常数表达式
)
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
难度: 困难查看答案及解析
-
下列关于焓变和熵变的说法正确的( )
A. 常温下反应C(s)+CO(g)=2CO(g)不能自发进行,则该反应△H>0
B. 自发反应的熵一定増大非自发反应的熵一定减小
C. 凡是放热反应都是自发的,凡是吸热反应都是非自发的
D. 反应2Mg(s)+CO₂(g)=C(s)+2MgO(s)能自发进行,则该反应△H>0
难度: 中等查看答案及解析
-
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
A. 图
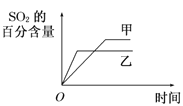 表示温度对平衡的影响,且甲温度较高
表示温度对平衡的影响,且甲温度较高B. 图
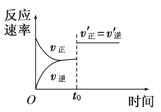 表示t0时刻恒容充入He(g)
表示t0时刻恒容充入He(g)C. 图
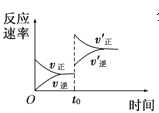 表示t0时刻增大O2的浓度对反应速率的影响
表示t0时刻增大O2的浓度对反应速率的影响D. 图
 中a点v正 > v逆
中a点v正 > v逆难度: 简单查看答案及解析
-
一定温度下,向10ml0.1mol/L的醋酸溶液和10ml0.1mol/L的盐酸中投入足量相同大小的锌粒,下列说法正确的是( )
A.反应起始速率相等 B.生成的H2质量相等
C.原溶液的pH相等 D.盐酸生成的H2多
难度: 中等查看答案及解析
-
已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是( )
A. 该溶液的pH=4
B. 此溶液中,HA约有0.1%发生电离
C. 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
难度: 中等查看答案及解析
-
下列事实能说明醋酸(CH3COOH)是弱酸的是
A. 醋酸溶液能使紫色石蕊试液变红
B. 将pH=3的醋酸溶液稀释10倍,溶液的pH<4
C. 醋酸溶液能与鸡蛋壳反应生成二氧化碳
D. 等体积等浓度的醋酸溶液与氢氧化钠溶液恰好完全反应
难度: 中等查看答案及解析
-
已知甲、乙、丙、丁四种溶液分别为CH3COONa、NH3•H2O、CH3COOH、Na2SO4中的一种,相同温度下,甲与乙两种溶液的pH相同,甲与丙两种溶液中的水的电离程度相同,则丁为
A. NH3•H2O B. CH3COONa C. CH3COOH D. Na2SO4
难度: 简单查看答案及解析
-
下列说法正确的是
A.t ℃时,某溶液pH=6,则该溶液一定为酸性
B.常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低
C.常温下,将pH=11的NaOH溶液和pH=3的HCl溶液等体积混合后,溶液pH=7
D.常温下,物质的量浓度和体积相同的Na2CO3、Na2SO4、HCl溶液混合后,pH<7
难度: 中等查看答案及解析
-
两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是
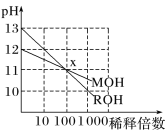
A. MOH是一种弱碱
B. 在x点,c(M+)=c(R+)
C. 稀释前,c(ROH)=10c(MOH)
D. 稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的10倍
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
C.无色透明的溶液中: Fe3+、Al3+、NO3-、SO42-
D.
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
难度: 中等查看答案及解析