-
(1)已知常温时,a mol/L醋酸与0.1mol/LNaOH溶液等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________ (用含a的代数式表示)
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:

①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是_____(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________
-
向0.1mol/LNaOH溶液中加入等体积的cmol/L醋酸溶液后恰好呈中性(忽略溶液混合时的体积变化)。回答下列问题:
(1)混合溶液中离子浓度大小顺序为:___;
(2)计算CH3COOH的电离常数Ka=___(用含c的代数式表示)。
-
设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.常温下,1L0.1mol·L−1醋酸钠溶液中加入醋酸至中性,则溶液中CH3COO-数为0.1NA
B.0.1molFeCl3完全水解生成的Fe(OH)3胶体粒子数为0.1NA
C.2L0.5mol·L-1亚硫酸溶液中含有的H+离子数为2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1 NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(2)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
H++A2-。常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
Ca2+(aq)+A2-(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
-
常温时,以下4种溶液pH最小的是
A.0.01mol/L醋酸溶液
B.0.02mol/L醋酸与0.02mol/LNaOH溶液等体积混合液
C.0.03mol/L醋酸与0.01mol/LNaOH溶液等体积混合液
D.pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液
-
常温时,以下4种溶液pH最小的是( )
A.0.01mol/L醋酸溶液
B.0.02mol/L醋酸与0.02mol/LNaOH溶液等体积混合
C.0.02mol/L醋酸与0.01mol/LNaOH溶液等体积混合
D.pH=2的盐酸与pH=12的NaOH溶液等体积混合
-
常温时,以下4种溶液pH最小的是
A.0.02mol/L醋酸溶液与等体积的水混合
B.0.02mol/L醋酸与0.02mol/LNaOH溶液等体积混合液
C.0.03mol/L醋酸与0.01mol/LNaOH溶液等体积混合液
D.pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液
-
下列有关叙述中正确的是( )
A. 常温下, 的
的 与
与 混合溶液中:
混合溶液中:
B. NaCl溶液和 溶液均显中性,两溶液中水的电离程度相同
溶液均显中性,两溶液中水的电离程度相同
C. 已知 时
时 溶液显碱性,则
溶液显碱性,则 时的电离平衡常数
时的电离平衡常数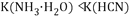
D.  醋酸溶液加少量水稀释
醋酸溶液加少量水稀释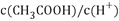 增大
增大
-
在0.1mol/L的醋酸溶液中,存在平衡:CH3COOH CH3COO- +H+ 下列说法正确的是( )
CH3COO- +H+ 下列说法正确的是( )
A.加水稀释,中和此溶液所需的0.1mol/LNaOH溶液的体积增大
B.加入固体碳酸钠,平衡正向移动,c(CH3COOH)减小
C.加入固体醋酸钠,平衡逆向移动,c(H+)、c(CH3COO-)均减小
D.加水稀释,电离程度增大,由CH3COOH电离出来的n(H+)增大
-
在0.1mol/L的醋酸溶液中,存在平衡:CH3COOH CH3COO- +H+下列说法正确的是( )
CH3COO- +H+下列说法正确的是( )
A.加水稀释,中和此溶液所需的0.1mol/LNaOH溶液的体积增大
B.加入固体碳酸钠,平衡正向移动,c(CH3COOH)减小
C.加入固体醋酸钠,平衡逆向移动,c(H+)、c(CH3COO-)均减小
D.加水稀释,电离程度增大,由CH3COOH电离出来的n(H+)增大

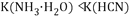
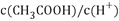 增大
增大