-
下列叙述中,不能用平衡移动原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于SO2和O2合成SO3
C. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D. 黄绿色的氯水光照后颜色变浅
难度: 中等查看答案及解析
-
有些化学反应反应速率很慢且副反应较多,测定这些反应的焓变可运用
A.阿伏加德罗定律 B.勒夏特列原理 C.盖斯定律 D.质量守恒定律
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.有能量变化的过程一定是化学变化过程 B.需要加热才能发生的反应是吸热反应
C.化学反应中一定伴有能量的变化 D.物质发生燃烧的反应不一定是放热反应
难度: 简单查看答案及解析
-
现在电视上有一个“自热米饭”的广告播得很火,它介绍在食用时,将一无色液体加入到一白色固体中,放上装米饭的盒子,过几分钟米饭就热气腾腾,可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合 ( )
A.硝酸铵和水 B.浓硫酸和水
C.氧化钙和水 D.氯化钠和水
难度: 简单查看答案及解析
-
下列说法中有明显错误的是
A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.活化分子之间发生的碰撞一定为有效碰撞
C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D.加适宜的催化剂,可使活化分子的百分数大大增加,从而增大反应速率
难度: 中等查看答案及解析
-
1molN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ的热量,该反应的正确的热化学方程式为( )
A.N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622kJ·mol-l
B.N2H4(l)+O2(l)=N2(g)+2H2O(g) △H=-622kJ·mol-l
C.N2H4(l)+O2(l)=N2(g)+2H2O(l) △H=+622kJ·mol-l
D.N2H4(l)+O2(l)=N2(g)+2H2O(g) △H=+622kJ·mol-l
难度: 简单查看答案及解析
-
已知4NH3(g)+5O2(g)
4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO)
难度: 简单查看答案及解析
-
反应X(g)+Y(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
X(g)+3Y(g)⇌2Z(g) ΔH=-a kJ·molˉ1,一定条件下,将1 mol X和3 mol Y通入2 L的恒容密闭容器中,反应10 min,测得Y的物质的量为2.4 mol。下列说法正确的是
A. 10 min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
B. 第10 min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C. 10 min内,消耗0.2 mol X,生成0.4 mol Z
D. 第10 min时,Z的物质的量浓度为0.4mol/L
难度: 简单查看答案及解析
-
一定温度下,对可逆反应A(g)+2B(g)
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.A物质与C物质的反应速率之比为1∶2
B.单位时间内消耗a mol A,同时消耗3a mol C
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
难度: 简单查看答案及解析
-
在密闭容器中一定量的混合气体发生反应xA(g)+yB(g)
zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
A.B的转化率降低 B.平衡向正反应方向移动
C.x+y<z D.C的体积分数增大
难度: 中等查看答案及解析
-
对已达到化学平衡的反应2X(g)+Y(g)
2Z(g),减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
在FeCl3溶液中滴加无色的KSCN溶液后,有以下可逆反应存在:FeCl3+3KSCN
Fe(SCN)3+3KCl。已知Fe(SCN)3呈血红色,则在该平衡体系中加入少量FeCl3晶体后(忽略溶液体积的变化),红色将( )
A.变深 B.变浅 C.不变 D.无法确定
难度: 简单查看答案及解析
-
二氧化氮存在下列平衡2NO2 (g)
N2O4(g);△H<0。在测定NO2 相对分子质量时,下列条件中较为适宜的是
A.温度130℃,压强3.03×105pa B.温度25℃, 压强1.01×105pa
C.温度130℃,压强5.05×104pa D.温度0℃, 压强5.05×104pa
难度: 中等查看答案及解析
-
稀氨水中存在下述电离平衡:NH3+H2O
NH3·H2O
NH4++OH-试分析对该体系进行如下哪种操作时,平衡正向移动( )
A.向溶液中加入氯化铵固体 B.向溶液中加入氢氧化钠固体(恒温)
C.降温 D.向溶液中加水稀释
难度: 中等查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大,pH变小,呈中性
B.水的离子积变大,pH变大,呈碱性
C.水的离子积变小,pH变大,呈碱性
D.水的离子积变小,pH变大,呈酸性
难度: 中等查看答案及解析
-
反应2X(g)+Y(g)
2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量(n)与反应时间(t)的关系如图所示。
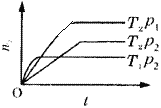
下述判断正确的是( )
A.T1>T2,p1>p2 B.T1<T2,p1>p2
C.T1<T2,p1<p2 D.T1>T2,p1<p2
难度: 简单查看答案及解析
-
在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)⇌2HI(g) △H<0,通过下列操作,能使反应速率减慢的是
①保持容器容积不变,向其中加入1molH2
②保持容器容积不变,向其中加入1molN2(N2不参加反应)
③保持容器内压强不变,向其中加入1molN2(N2不参加反应)
④保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g)
⑤提高起始的反应温度
A. 只有③ B. 只有④ C. ①②⑤ D. ①②④⑤
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应是焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O
CO2+H2
难度: 中等查看答案及解析
-
向某氨水中加入醋酸溶液,反应方程式如下:NH3·H2O+CH3COOH=CH3COONH4+H2O滴加过程,溶液的导电能力(I)与加入醋酸溶液的体积(V)关系正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析