-
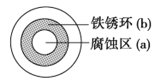
在世界海运史上曾发生过这样一个悲剧:一艘名叫“阿那吉纳”的货轮满载着精铜砂,在向日本海岸行驶时突然发生大面积漏水,最终沉没。坚硬的钢制船体为什么会突然漏水呢?事后的事故调查结果表明导致沉船的原因与船上的精铜砂密切相关。下列对此调查结论的理解正确的是( )
A. 精铜砂装载过多导致沉船
B. 运输途中铜与空气中的氧气发生氧化反应导致质量增大超过船的承载能力
C. 在潮湿的环境中,船体与铜构成了原电池,加速了作为负极的船体的腐蚀
D. 在潮湿的环境中,船体与铜构成了电解池,钢制船体作阳极而被氧化腐蚀
难度: 简单查看答案及解析
-
埋在地下的输油铁管道,在下列情况下,被腐蚀速率最慢的是( )
A.在含铁元素较多的酸性土壤中
B.在潮湿疏松透气的土壤中
C.在干燥致密不透气的土壤中
D.在含碳颗粒较多,潮湿透气的中性土壤中
难度: 中等查看答案及解析
-
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为( )
A.a>c>d>b B.a>b>c>d C.c>a>b>d D.b>d>c>a
难度: 简单查看答案及解析
-
下面列出了电解不同物质的电极反应式,其中错误的是( )
A.以惰性电极电解饱和食盐水阴极:Na++e−═Na
B.用铜电极电解CuSO4溶液阳极:Cu═Cu2++2e−
C.以惰性电极电解熔融NaCl阴极:Na++e−═Na
D.以惰性电极电解NaOH溶液阳极:4OH−═2H2O+O2↑+4e−
难度: 简单查看答案及解析
-
下列关于反应热的说法正确的是
①通常情况下,化学反应中能量的转化主要是化学能和热能之间的转化。
②同一化学反应在不同温度下进行,反应热的数值不同。
③反应热通常用Q表示,反应放热时,Q为负值,反应吸热时,Q为正值。
A.只有③ B.只有①② C.只有①③ D.全部正确
难度: 中等查看答案及解析
-
如下图所示装置中,属于电解池的是 ( )
A.

B.

C.

D.

难度: 简单查看答案及解析
-
反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.
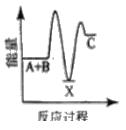 B.
B. 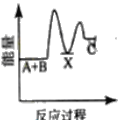
C.
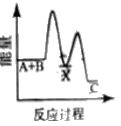 D.
D. 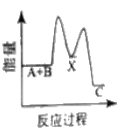
难度: 中等查看答案及解析
-
在测定中和反应反应热的实验中,下列叙述错误的是
A. 向小烧杯中加入盐酸,测量的温度为盐酸的起始温度
B. 实验中可使酸或碱略过量
C. 向小烧杯中加碱液时,碱液的温度应与酸的温度相同
D. 可以用氢氧化钾代替氢氧化钠,浓硫酸代替盐酸
难度: 简单查看答案及解析
-
已知: (1)Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s),ΔH=+234.1kJ•mol-1
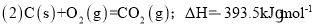 则
则的ΔH是( )
A.-824.4 kJ•mol-1 B.-627.6kJ•mol-1 C.-744.7kJ•mol-1 D.-169.4kJ•mol-1
难度: 中等查看答案及解析
-
常温常压下,1g H2在足量Cl2中燃烧生成HCl气体,放出 92.3kJ的热量,则该反应的热化学方程式书写正确的是
A.H2(g)+Cl2(g)═2HCl(g);△H=-92.3 kJ/mol
B.1/2H2(g)+1/2Cl2(g)═HCl(g);△H=+92.3kJ/mol
C.H2+Cl2═2HCl; △H=-184.6kJ/mol
D.2HCl(g)═H2(g)+Cl2(g);△H=+184.6kJ/mol
难度: 中等查看答案及解析
-
电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上析出的物质分别是( )。
A.Cu和Cl2 B.H2和Cl2 C.H2和O2 D.Cu和O2
难度: 简单查看答案及解析
-
关于电解池的叙述不正确的是
A.与电源正极相连的是电解池的阴极
B.电解质溶液中的阳离子向阴极移动
C.在电解池的阳极发生氧化反应
D.电子从电源的负极沿导线流入电解池的阴极
难度: 简单查看答案及解析
-
如图所示,U形管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是
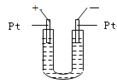
A.蓝、紫、红 B.红、蓝、紫 C.红、紫、蓝 D.蓝、红、紫
难度: 中等查看答案及解析
-
许多金属都可以通过电解的方法达到精炼的目的,下列有关该方法的叙述正确的是
A.杂质的粗金属做阳极,与电源正极相连
B.阴极只要是导体即可,与精炼过程无关
C.电解质溶液除了含有精炼的金属离子外,绝对不能含有其他金属离子
D.在精炼过程中,电解质溶液的成分不发生任何变化
难度: 中等查看答案及解析
-
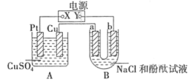
某原电池装置如图所示。下列有关叙述中,正确的是
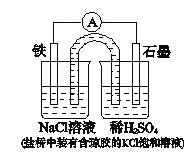
A.Fe作正极,发生氧化反应
B.负极反应: 2H+ + 2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
难度: 中等查看答案及解析
-
化学电池在通讯、交通及日常生活中有着广泛的应用.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③Cd为电池的正极 ④放电时化学能转变为电能.
A.①③ B.②④ C.①④ D.②③
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A. 铁表面镀锌,铁作阳极
B. 船底镶嵌锌块,锌作负极,以防船体被腐蚀
C. 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-
D. 工业上电解饱和和食盐水的阳极反应: 2Cl--2e-=Cl2↑
难度: 中等查看答案及解析
-
下列关于判断过程的方向的说法正确的是( )
A.所有自发进行的化学反应都是放热反应
B.高温高压下可以使石墨转化为金刚石是自发的化学反应
C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.同一物质的固、液、气三种状态的熵值相同
难度: 简单查看答案及解析
-
对于反应3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A.增大H2O(g)的浓度或减小H2的浓度,会使平衡常数减小
B.改变反应的温度,平衡常数不一定变化
C.K=
D.K=
难度: 中等查看答案及解析