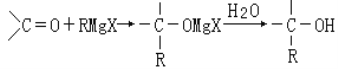-
《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列说法正确的是
A. “薪柴之灰”可与铵态氮肥混合施用 B. “以灰淋汁”的操作是萃取
C. “取碱”得到的是一种碱溶液 D. “浣衣”过程有化学变化
难度: 中等查看答案及解析
-
下列说法中不正确的有
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②光照氯水有气泡逸出,该气体是Cl2;
③燃煤时加入适量石灰石,可减少废气中SO2的量;
④pH在5.6~7.0之间的降水通常称为酸雨;
⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化。
⑥氯气易液化,液氯可以保存在钢瓶中;
⑦常温下浓硫酸可以用铝制容器盛放;
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
某同学在实验室里过滤一种浑浊溶液,发现滤出的液体仍浑浊。他检查实验装置发现漏斗外壁没有水,滤纸也未出现破损或小漏洞,则造成实验失败原因可能是下列操作中的
A.滤纸高出漏斗边缘的部分未剪掉 B.滤纸与漏斗之间有气泡未被排掉
C.倾倒液体时液面高于滤纸边缘 D.过滤时玻璃棒靠在一层滤纸一边
难度: 中等查看答案及解析
-
下列实验合理的是

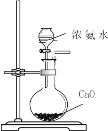
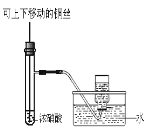
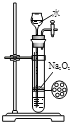
A.配制一定浓度硫酸
B.制备少量氨气
C.制备并收集少量NO2气体
D.制备少量氧气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
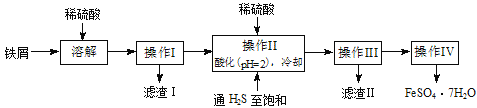
将磁性氧化铁放入稀HNO3中可发生如下反应: 3Fe3O4 + 28HNO3= 9Fe(NO3)x+ NO↑+ 14H2O下列判断合理的是 ( )
A.Fe(NO3)x中的x为2
B.反应中每还原0.2 mol氧化剂,就有0.6 mol电子转移
C.稀HNO3在反应中只表现氧化性
D.磁性氧化铁中的所有铁元素全部被氧化
难度: 中等查看答案及解析
-
一定体积的N2、O2、CO2混合气体通过足量的Na2O2后,同温同压下体积变为原来的0.75倍,原混合气体中N2、O2、CO2物质的量之比可能为
A.1∶1∶2 B.4∶3∶5 C.1∶2∶1 D.6∶7∶14
难度: 中等查看答案及解析
-
下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是
① 向Ca(ClO)2溶液中通入过量CO2
② 向AlCl3溶液中逐滴加入过量氨水
③ 向AgNO3溶液中逐滴加入过量氨水
④ 向Na2SiO3溶液中逐滴加入过量的盐酸
A.只有②③ B.只有①③ C.只有①②③ D.①②③④
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为( )
A.碳酸钠的水解反应:CO32-+H3O+
HCO3- +H2O
B.大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
C.氢氧化铁与氢碘酸混合:Fe(OH)3+3H+=Fe3++3H2O
D.向偏铝酸钠溶液中通入过量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B. Fe(OH)3胶体无色、透明,能发生丁达尔现象
C. H2、SO2、CO2三种气体都可用浓硫酸干燥
D. SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
A.标准状况下,6.72LHF含有的电子总数为3NA
B.室温下,21.0g乙烯和丁烯的混合气体中含有的碳氢共价键数目为3NA
C.36g镁在足量的氮气中完全燃烧共转移的电子数为3NA
D.1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
难度: 中等查看答案及解析
-
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于所得溶液中阳离子的判断正确的是
A.一定有Fe2+,可能有Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C.只有Fe2+和Cu2+ D.只有Fe2+
难度: 中等查看答案及解析
-
布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是( )

A.布洛芬的分子式为C13H18O2
B.布洛芬与苯乙酸是同系物
C.1mol 布洛芬最多能与3mol 氢气发生加成反应
D.布洛芬在苯环上发生取代反应,其一氯代物有4种
难度: 中等查看答案及解析
-
下列各组离子在指定条件下一定能大量共存的是( )
A.能使红色石蕊试纸变蓝的溶液中:K+、CO32-、NO3-、AlO2-
B.能使碘化钾淀粉试纸变蓝的溶液中: Na+、NH4+、S2-、Br-
C.在加入铝粉能产生氢气的溶液中:NH4+、 Fe2+、SO42-、NO3-
D.在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A.同温下Na2CO3比NaHCO3易溶于水
B.Na2CO3比NaHCO3稳定
C.石灰水能与Na2CO3反应,而不能与NaHCO3反应
D.与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量要少
难度: 简单查看答案及解析
-
将11.9克由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7克。另取等质量的合金溶于过量的稀硝酸中,标准状况下生成了6.72LNO,向反应后的溶液中加入过量的NaOH溶液,则最终所得沉淀的质量为
A.19.4g B.22.lg C.27.2g D.30g
难度: 困难查看答案及解析
-
1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是 ( )

A.偏铝酸钠、氢氧化钡、硫酸
B.氯化铝、氯化镁、氢氧化钠
C.氯化铝、氯化铁、氢氧化钠
D.偏铝酸钠、氯化钡、硫酸
难度: 困难查看答案及解析