-
下列有关能量叙述不正确的是
A.活化能的大小对化学反应前后的能量变化不产生影响
B.化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因
C.盐酸和NaOH(aq)反应的中和热OH=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热ΔH=2×(-57.3)kJ/mol
D.CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热ΔH=+2×283.0kJ/mol
难度: 中等查看答案及解析
-
反应A2+3B2 =2AB3在2L的密闭容器中进行,5s后,A2的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A.v (A2)=0.01 mol/(L·s) B.v (B2)=0.08 mol/(L·s)
C.v (AB3)=0.03 mol/(L·s ) D.v (AB3)=0.06 mol/(L·s )
难度: 简单查看答案及解析
-
100 ml 6 mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2SO4(s) B.H2O C.NaOH溶液 D.4 mol/L H2SO4
难度: 中等查看答案及解析
-
在一定条件下,在密闭容器中,发生可逆反应2NO2(g)
2NO(g) +O2(g),达到平衡状态的标志是:
A.单位时间生成n mol O2,同时生成2n mol NO
B.用NO2、NO、O2表示反应速率之比为2:2:1的状态
C.NO2、NO、O2的物质的量之比为2:2:1的状态
D.混合气体的颜色不再改变的状态
难度: 简单查看答案及解析
-
下列措施或事实不能用勒夏特列原理解释的是( )
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B.棕红色的NO2加压后颜色先变深后变浅(已知:2NO2(g)
N2O4(g))
C.煅烧粉碎的硫铁矿利于SO2的生成
D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
难度: 简单查看答案及解析
-
已知某可逆反应mA(g)+nB(g)
pC(g),在密闭容中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )
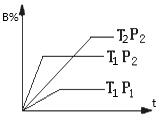
A.T1<T2、P1>P2、m+n>p,△H<0
B.T1<T2、P1>P2、n+n<p,△H<0
C.T1>T2、P1<P2、n+n<p,△H>0
D.T1>T2、P1<P2、m+n>p,△H>0
难度: 中等查看答案及解析
-
某反应2AB(g)
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A.ΔH <0,ΔS>0 B.ΔH <0,ΔS<0
C.ΔH >0,ΔS>0 D.ΔH >0,ΔS<0
难度: 简单查看答案及解析
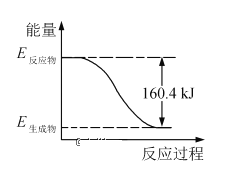
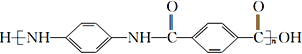
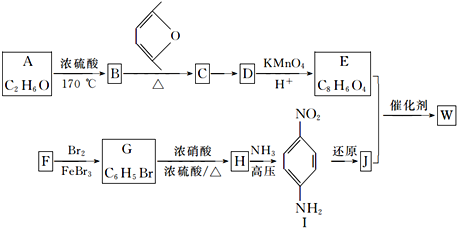
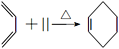
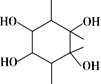 ,设计合成路线(无机试剂任选):___。
,设计合成路线(无机试剂任选):___。