-
2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)(液态)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全反应生成氮气和1 mol气态水过程中的能量变化图。

(1)该反应属于________(填“吸热”或“放热”)反应。
(2)写出该火箭推进器中相关反应的热化学方程式:__________________。
(3)若该火箭推进器中H2O2有12 mol共价键发生断裂,则反应释放出的热量______kJ。
-
(1)2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全燃烧生成氮气和1mol气态水过程中的能量变化图。
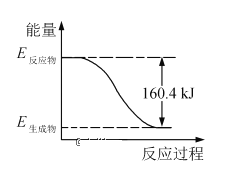
①该反应属于___(填“吸热”或“放热”)反应。
②写出该火箭推进器中相关反应的热化学方程式:___。
③若该火箭推进器中H2O2有24mol共价键发生断裂,则反应释放出的热量为__kJ。
(2)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___。
(3)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
根据键能数据计算以下反应的反应热△H:CH4(g)+4F2(g)=CF4(g)+4HF(g) △H=__。
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。金红石(TiO2)制钛,涉及的步骤为:TiO2—TiCl4—Ti,已知:C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol ①
O2(g)+2CO(g)=2CO2 (g) ΔH=-566kJ/mol ②
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ/mol ③
写出金红石与氯气、石墨制取TiCl4(s)和CO的热化学反应方程式___。
-
2016年9月15日“天宫二号空间实验室发射任务圆满成功”中国载人航天工程进入崭新时期。其 中火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.2mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出128.3kJ的热量。
中火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.2mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出128.3kJ的热量。
(1)已知H2O(l)=H2O(g) ΔH=+44kJ·mol-1。则8g液态肼与液态双氧水反应生成液态水时放出的热量是___________kJ。
(2)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
气态肼和二氧化氮反应的热化学方程式为 。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉、二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2 Al2O3(s)+3TiC(s) ΔH=-1176kJ·mol-1,则反应过程中,每转移0.3mol电子放出的热量为 kJ。
Al2O3(s)+3TiC(s) ΔH=-1176kJ·mol-1,则反应过程中,每转移0.3mol电子放出的热量为 kJ。
-
(6分)“嫦娥二号”卫星于2010年10月1日18时59分57秒在西昌卫星发射中心发射升空,并且获得了圆满成功。火箭推进器中装有强还原剂液态肼(N2H4)和强氧化剂液态H2O2,当它们混合反应时,产生大量氮气和水蒸气,并放出大量的热.已知0.4 mol液态肼与足量的液态H2O2反应生成氮气和水蒸气,放出256.652 kJ的热量.
(1)反应的热化学方程式为_________________________________________________
(2)又知H2O(l)===H2O(g) ΔH=+44 kJ/mol,则16 g液态肼与足量液态过氧化氢反应生成液态水时放出的热量是_______________ kJ.
(3)此反应用于火箭推进,除释放出大量的热和快速产生大量气体外,还有一个很大的优点是________________________.
-
(6分)“嫦娥三号”卫星于2013年12月2日1时30分57秒携带月球车“玉兔号”在西昌卫星发射中心发射升空,并且获得了圆满成功。火箭推进器中装有强还原剂液态肼(N2H4)和强氧化剂液态H2O2,当它们混合反应时,产生大量氮气和水蒸气,并放出大量的热.已知0.4 mol液态肼与足量的液态H2O2反应生成氮气和水蒸气,放出256.652 kJ的热量。
(1)反应的热化学方程式为_________________________________________________。
(2)又知H2O(l)===H2O(g)ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态过氧化氢反应生成液态水时放出的热量是_______ kJ。
(3)此反应用于火箭推进,除释放出大量的热和快速产生大量气体外,还有一个很大的优点是________________。
-
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.5 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出320.8 kJ的热量。
(1)肼的电子式为___________________,过氧化氢的电子式为__________________。
(2)写出反应的热化学方程式:________________________________________________。
(3)在25 ℃、101 kPa时,已知18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
| O===O | H—H | H—O(g) |
| 1 mol化学键断裂时 需要吸收的能量/kJ | 496 | 436 | 463 |
写出表示H2燃烧热的热化学方程式___________________________________________;则32 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ。
(4)联氨和H2O2可作为火箭推进剂的主要原因为_________________________________。
(5)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为____________(已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。
-
北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
-
2016年6月25日20时00分,我国新一代运载火箭“长征七号”在海南文昌航天发射场点火升空,首飞成功。“长征七号”运载火箭使用的是液氧煤油推进剂,下列说法不正确的是
A.工业上可利用空气冷冻成液体后再分离来获得液氧
B.煤油燃烧后的主要产物是水和二氧化碳,绿色环保
C.煤油属于纯净物.主要成分是烃
D.火箭装载的燃料越多,说明其动力越大
-
天宫一号于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历一个漫长的过程.
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式:2KNO3+S+3C═K2S+N2↑+3CO2↑.
①上述反应中的氧化剂是_____;若有0.5mol S参加反应,则转移的电子的物质的量为_____mol;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式_______;
实验二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊后又变澄清.变浑浊的物质是_____(化学式表示);
设计实验方案证明该澄清液中含有Cl﹣_____.
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂.高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式_____;
(3)火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式_____;
-
(10分,每空2分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4+2 H2O2 N2+4H2O,已知0.4 mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量。
N2+4H2O,已知0.4 mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量。
(1)反应的热化学方程式为_________________________________________________。
(2)又已知:H2O(l) H2O(g);ΔH=+44 kJ/mol。则16 g液态肼和足量的液态双氧水反应生成液态水时放出的热量是_______________kJ。
H2O(g);ΔH=+44 kJ/mol。则16 g液态肼和足量的液态双氧水反应生成液态水时放出的热量是_______________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有很大的优点是
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计
成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为

