-
下列关于反应与能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,E反应物<E生成物
B.CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.2kJ·mol-1,E反应物<E生成物
C.2HCl(g)=H2(g)+Cl2(s) ΔH=+92.3kJ•mol-1,1molHCl在密闭容器中分解后放出92.3kJ的能量
D.将0.5molN2和1.5molH2置于密闭的容器中充分反应后生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6kJ·mol-1
难度: 简单查看答案及解析
-
温度为T时,向2 L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)
C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )

A.反应前10 min内反应的平均速率为v(D)=0.3 mol·L-1·min-1
B.若平衡时保持温度不变,压缩容器体积,平衡逆向移动,平衡常数K值减小
C.反应至15 min时,其他条件不变,改变的条件可能是缩小容器体积
D.反应至15 min时,其他条件不变,改变的条件可能是降低反应体系温度
难度: 简单查看答案及解析
-
25°C时,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
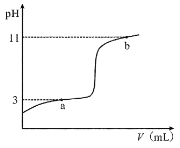
A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
难度: 困难查看答案及解析
-
下列操作能达到相应实验目的的是( )
实验目的
操作
A
检验绿茶中是否含有酚类物质
向茶水中滴加FeCl3溶液
B
测定84消毒液的pH
用洁净的玻璃棒蘸取少许84消毒液滴在pH试纸上
C
除去苯中混有的少量苯酚
向苯和苯酚的混合物中滴加溴水,过滤后分液
D
实验室制备乙酸乙酯
向试管中依次加入浓硫酸、乙醇、乙酸和碎瓷片,加热
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在25℃和100℃两种温度下,碳酸钙(CaCO3)在水中的溶解平衡曲线如图所示:下列有关说法正确的是( )

A.CaCO3(s)
Ca2+(aq)+CO32-(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25℃时,水分挥发,可使溶液由a点移动到c点
D.25℃,Ksp(CaCO3)=2.8×10-9
难度: 中等查看答案及解析
-
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol·L-1CH3COONa溶液与0.1mol·L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1mol·L-1NH4Cl溶液与0.1mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合:
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1mol·L-1Na2C2O4溶液与0.1mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
难度: 中等查看答案及解析
-
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离子浓度/mol·L-1
Na+
Mg2+
Ca2+
Cl-
HCO3-
0.439
0.050
0.011
0.560
0.001
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
难度: 中等查看答案及解析
-
若用AG表示溶液的酸度,AG的定义为AG=lg
。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是

A.室温下,醋酸的电离常数约为10-5
B.A点时加入氢氧化钠溶液的体积为20.00 mL
C.若B点为40 mL,所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从A到B,水的电离程度逐渐变大
难度: 中等查看答案及解析
-
某密闭容器中充入一定量N2、H2发生反应N2(g)+3H2(g)
2NH3(g),测得NH3浓度与反应温度关系如图。下列说法正确的是( )

A.该反应△H>0
B.N2转化率:c>b>a
C.化学反应速率:c>b>a
D.平衡常数K:b>c>a
难度: 中等查看答案及解析
-
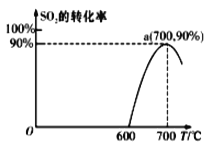
在容积不变的密闭容器中存在如下反应:2SO2 (g)+O2 (g)
2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是( )
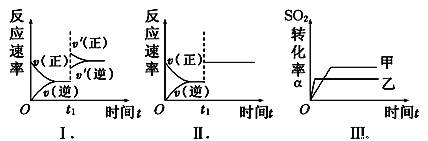
A.图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C.图Ⅲ表示的是压强对化学平衡的影响,且P甲大于P乙
D.图Ⅲ表示的是温度对化学平衡的影响,且T甲小于T乙
难度: 中等查看答案及解析
-
下列操作或试剂的选择合理的是( )
A.焰色反应时需用稀硫酸洗净铂丝,并在火焰上灼烧至无色。
B.用湿润的pH试纸测得某碱性溶液的pH为13
C.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
D.用丁达尔效应可鉴别
溶液和
胶体
难度: 简单查看答案及解析
-
利用下述操作步骤:①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量
生成
沉淀 ⑤加盐酸生成
沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
A.②③④③ B.②③⑤③ C.①③④③ D.②⑤③④
难度: 简单查看答案及解析
-
下列离子方程式不正确的是
A.实验室用过量NaOH溶液吸收二氧化硫气体:2OH-+SO2=SO32-+H2O
B.久置的二氧化硫水溶液滴加BaCl2溶液出现白色沉淀:Ba2++SO32-=BaSO3↓
C.小苏打溶液中加入足量的澄清石灰水:HCO3-+OH-+Ca2+=CaCO3↓+H2O
D.在淀粉碘化钾溶液中加入稀硫酸酸化,再通入ClO2气体,溶液变蓝:2ClO2+10I-+8H+=5I2+2Cl-+4H2O
难度: 中等查看答案及解析
-
氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC12•2H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )

A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl2•2H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
难度: 中等查看答案及解析
-
工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体。

下列说法错误的是
A.步骤a中还需要加入适量的氧气和水
B.保温去铁后过滤,铁元素主要以+2价的沉淀形式被过滤出去
C.蒸发浓缩的过程中加入适当的硝酸,目的是抑制硝酸铜的水解
D.硝酸铜溶液中离子浓度大小:
难度: 困难查看答案及解析
-
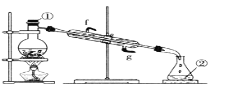
已知:酸式乙二酸钠与浓硫酸共热时反应为
 。利用该反应所产生的气体(X)用有关仪器装置进行实验:
。利用该反应所产生的气体(X)用有关仪器装置进行实验:
下列说法不正确的是( )
A.对I装置,活塞
关闭,打开活塞
,在导管D处能得到纯净而干燥的CO
B.当A选项反应完成后,再关闭活塞
,打开活塞
,在导管D处得到纯净而干燥的
C.利用装置I中D处所得纯净CO气体,通过实验装置II能够说明CO具有还原性
D.实验装置III与实验装置II相比较,能减少CO污染,能顺利完成氧化铁还原实验
难度: 中等查看答案及解析
-
现有八种物质:①甲烷、②苯、③聚乙烯、④氯乙烯、⑤2—丁炔、⑥环己烷、⑦邻二甲苯、⑧乙醛,既能使酸性高锰酸钾溶液褪色,又能与溴水反应使之褪色的是( )
A.③④⑤⑧ B.④⑤⑦⑧ C.④⑤⑧ D.②③④⑤⑦⑧
难度: 简单查看答案及解析
-
下列叙述正确的是
①氧化还原反应的实质是电子的得失。
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下。
③标准状况下,1 L HCl和1 L H2O的物质的量相同。
④溶于水得到的溶液可以导电的物质就是电解质。
⑤利用丁达尔现象区别溶液和胶体。
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同。
⑦在同温同体积时,气体物质的物质的量越大,则压强越大。
⑧同温同压下,气体的密度与气体的相对分子质量成正比。
A.①②③④ B.②③⑥⑦⑧ C.⑤⑦⑧ D.④⑤⑦⑧
难度: 中等查看答案及解析