-
常温下,Fe、Al在浓硫酸中钝化,浓硫酸表现了( )
A. 难挥发性 B. 吸水性 C. 脱水性 D. 强氧化性
难度: 简单查看答案及解析
-
下列过程属于物理变化的是
A. 煤的干馏 B. 石油的分馏 C. 石油裂化 D. 石油裂解
难度: 中等查看答案及解析
-
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( )
A. 脱氧过程中铁作为原电池正极
B. 负极的电极反应为:Fe-3e→Fe3+
C. 正极的电极反应为:2H2O+O2+4e→4OH-
D. 脱氧过程是吸热反应,可降低温度,延长糕点保质期
难度: 简单查看答案及解析
-
下列物质对水的电离平衡没有影响的是
A. NaI B. KF C. KAl(SO4)2 D. NaHSO4
难度: 中等查看答案及解析
-
SiF4与SiCl4分子都是正四面体结构。下列判断正确的是( )
A.键长:Si-F>Si-Cl B.键能:Si-F>Si-Cl
C.沸点:SiF4>SiCl4 D.共用电子对偏移程度:Si-Cl>Si-F
难度: 中等查看答案及解析
-
关于
Ts中数字的描述正确的是
A.117是
Ts 的质子数 B.117是
Ts的中子数
C.291是Ts元素的相对原子质量 D.291是Ts元素的质量数
难度: 简单查看答案及解析
-
下列物质属于混合物的是
A.冰醋酸 B.汽油 C.硫磺 D.丙三醇
难度: 简单查看答案及解析
-
按照有机物的命名规则,下列命名正确的是
A.1,2-二甲基戊烷 B.3,4-二甲基戊烷
C.2,2-二甲基丁烷 D.2,3,3-三甲基丁烷
难度: 简单查看答案及解析
-
关于乙醛,下列化学用语正确的是
A. 官能团 —COH B. 比例模型
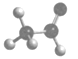
C. 最简式 C2H4O D. 结构式 CH3CHO
难度: 中等查看答案及解析
-
现有pH为1的100mL 0.1moL/L 的AlCl3溶液,下列有关判断正确的是:
A.溶液显酸性,主要因为铝离子水解导致的
B.溶液显酸性,主要因为溶液中有盐酸
C.溶液显碱性,主要因为铝离子水解导致的
D.溶液显碱性,主要因为铝离子水解导致的
难度: 简单查看答案及解析
-
不能鉴别0.1mol/L盐酸和0.1mol/LNaOH溶液的是
A.石蕊试液 B.甲基橙试液 C.酚酞试液 D.淀粉KI试液
难度: 简单查看答案及解析
-
工业生产氨气的适宜条件中不包括( )
A.用浓硫酸吸收产物 B.用铁触煤作催化剂
C.温度500℃左右 D.压强为20~50MPa
难度: 简单查看答案及解析
-
氮气常用作白炽灯泡中钨丝的保护气,这是因为
A. 氮气比空气轻 B. 氮气难溶于水
C. 氮气是无色无味的气体 D. 氮气很不活泼
难度: 简单查看答案及解析
-
准确量取22.00mL Na2SO3溶液,最合适的仪器是( )
A. 25mL量筒 B. 25mL滴定管
C. 50mL量筒 D. 有刻度的25mL烧杯
难度: 中等查看答案及解析
-
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
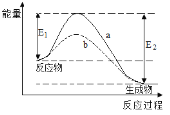
A.该反应为吸热反应
B.a与b相比,a的反应速率更快
C.a与b相比,反应的平衡常数一定不同
D.E2大于E1,说明总能量生成物比反应物低
难度: 简单查看答案及解析
-
下列转化过程不能一步实现的是
A. Al(OH)3→Al2O3 B. Al2O3→Al(OH)3
C. Al→AlCl3 D. Al→NaAlO2
难度: 简单查看答案及解析
-
通常情况下,仅凭下列事实能证明乙酸是弱酸的是
A.某乙酸溶液与锌粒反应产生气泡很慢 B.乙酸钠溶液pH>7
C.乙酸溶液能使石蕊变红 D.某乙酸溶液能导电能力弱
难度: 中等查看答案及解析
-
除去物质中含少量杂质的方法错误是
选项
物质(括号内为杂质)
实验方法
A
K2SO4 (K2CO3)
加入稀硫酸使溶液呈中性
B
NaCl (KNO3)
样品配制成热饱和溶液,冷却结晶,过滤
C
CO2(HCl)
通过NaHCO3饱和溶液,干燥
D
溴苯(溴)
加入足量NaOH溶液,充分振荡,分液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
关于晶体的叙述中,正确的是
A. 分子晶体中,共价键的键能越大,熔、沸点越高
B. 分子晶体中,分子间的作用力越大,该分子越稳定
C. 原子晶体中,共价键的键能越大,熔、沸点越高
D. 某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
难度: 中等查看答案及解析
-
测得某pH=2的溶液中有关数据如下:
离子
Na+
Fe3+
?
NO3-
SO42-
浓度(mol/L)
2.0×10-2
1.4×10-2
?
2.0×10-2
2.4×10-2
则该溶液中还可能大量存在的一种离子是
A.Cl- B.SO32- C.Ba2+ D.Al3+
难度: 简单查看答案及解析
 )
)