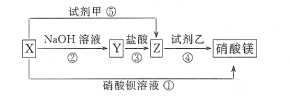
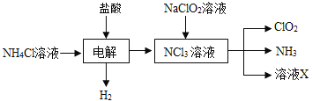
-
下列各组物质,按酸、混合物、碱顺序排列的是
A. 空气、硫酸铜、硫酸 B. 乙酸、空气、纯碱
C. 氧化铁、胆矾、熟石灰 D. 硝酸、蔗糖水、氢氧化铁
难度: 简单查看答案及解析
-
下列实验操作中叙述正确的是( )
A.萃取操作必须在分液漏斗中进行
B.振荡试管中液体时,手拿住试管,用手腕甩动
C.用剩的药品应收集起来放回原试剂瓶中
D.称量物质时先取小砝码,再依次取较大的砝码
难度: 简单查看答案及解析
-
如图是某学校实验室从化学试剂商店买回的硫酸试剂的标签部分内容。据此判断,下列说法正确的是( )

A. 1 mol Al 与足量的该硫酸产生2 g氢气
B. 配制 240 mL 4.6 mol/L 的稀硫酸需取该硫酸 40 mL
C. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
D. 该硫酸与等质量的水混合后所得溶液的物质的量浓度小于9.2 mol/L
难度: 困难查看答案及解析
-
下列关于电解质的说法正确的是( )
A.液态HCl不导电,所以HCl不是电解质
B.NH3溶于水形成的溶液能导电,所以NH3是电解质
C.SO2溶于水能导电,所以SO2是电解质
D.BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质
难度: 中等查看答案及解析
-
下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是( )
A.石灰水中和稀盐酸混合
B.小苏打溶液和柠檬水混合制汽水
C.人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾,常用于治疗牲口消化不良)溶液与BaCl2溶液混合
D.喝氯化钠溶液和蔗糖水的混合液治拉肚子
难度: 简单查看答案及解析
-
下列反应中,氯元素全部被氧化的是( )
A.2P+3Cl2
2PCl3 B.2NaCl(熔融)
2Na+Cl2↑
C.NaOH+HCl=NaCl+H2O D.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
难度: 简单查看答案及解析
-
实验室制Cl2反应为4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,下列说法不正确的是
A.还原剂是HCl,氧化剂是MnO2
B.每生成1mol Cl2,转移电子的物质的量为2mol
C.每消耗1mol MnO2,起还原剂作用的HCl消耗4mol
D.转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L
难度: 中等查看答案及解析
-
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
难度: 中等查看答案及解析
-
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Mg2+、Na+、SO42−、Cl− B.Na+、Cu2+、SO42−、NO3-
C.Na+、K+、OH−、Cl− D.Ba2+、CO32−、NO3-、K+
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
难度: 简单查看答案及解析
-
在FeCl2和CuCl2的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是 ( )
①只有Fe2+; ②Fe2+和Fe3+; ③Fe2+和Cu2+; ④Cu2+和
.
A.②③ B.②④ C.①④ D.①③
难度: 中等查看答案及解析
-
在一定条件下,某化合物X受热分【解析】
2XA↑+2B↑+4C↑,测得反应后生成的混合气体对H2的相对密度为11.43,在相同条件下,X的相对分子质量是( )
A.11.43 B.22.85 C.80.01 D.160.02
难度: 简单查看答案及解析
-
为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序( )
①过滤; ②加过量NaOH溶液; ③加适量盐酸; ④加过量Na2CO3溶液; ⑤加过量BaCl2溶液
A. ④②⑤ B. ④①②⑤③ C. ②⑤④①③ D. ①④②⑤③
难度: 困难查看答案及解析
-
向一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,如图中的曲线可近似表示整个过程中混合溶液的导电能力变化的是(用电流强度I表示)
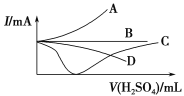
A. 曲线A B. 曲线B C. 曲线C D. 曲线D
难度: 中等查看答案及解析
-
下列反应中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是( )
A.
B.2Na2O2+2H2O=4NaOH+O2↑
C.
D.Mg+2H2O=Mg(OH)2↓+H2↑
难度: 中等查看答案及解析
-
滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
序号
装置
X溶液
现象
I
盐酸
溶液红色褪去,无沉淀,灯泡亮度没有明显变化
II
Na2SO4
溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
III
H2SO4
溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗
A. 实验I中溶液红色褪去,说明发生了反应H+ + OH- =H2O
B. 实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH-
C. 实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O
D. 将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同
难度: 中等查看答案及解析