-
如图为锌铜原电池装置,则下列说法不正确的是( )
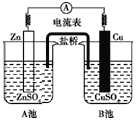
A.装置能将化学能转变为电能
B.装置盐桥的作用是使反应过程中ZnSO4溶液和CuSO4溶液保持电中性
C.装置中锌为负极,发生还原反应
D.电子由Zn极流向Cu极
难度: 简单查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
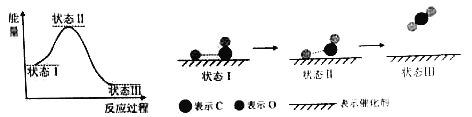
下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A.含20.0g NaOH 的稀溶液与稀盐酸完全中和,放出 28.7 kJ 的热量,则稀醋酸和稀NaOH 溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
B.已知反应2H2(g)+O2(g)=2H2O(l)ΔH=-571.6kJ·mol-1,则H2的燃烧热为571.6 kJ·mol-1
C.已知 C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
D.已知 2C(s)+2O2(g)=2CO2(g) ΔH1 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
难度: 中等查看答案及解析
-
四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:① v(A)=" 0.15mol/(L·s)②v(B)=" 0.6mol/(L·s) ③v(C)=" 0.4mol/(L·s)④v(D)=" 0.45mol/(L·s)。其中,反应进行得最快的是 ( )
A.① B.② C.③ D.④
难度: 简单查看答案及解析
-
反应A(s)+2B(g)
2C(g)在一密闭容器中进行,当改变下列条件之一时,一定能增大反应速率的是( )
A.增加A物质的量 B.降低温度
C.压缩反应容器体积 D.减少部分B物质
难度: 中等查看答案及解析
-
一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g)
4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
A.混合气体的平均摩尔质量不再变化 B.v(A)∶v(B)∶v(C)=1∶3∶4
C.混合气体的密度不再变化 D.C的体积分数不再变化
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 实验室中常用排饱和食盐水的方法收集Cl2
B. 对CO(g)+NO2(g)
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 升高温度能够促进水的电离
D. 在含有Fe(SCN)3的红色溶液中加少量铁粉,振荡静置,溶液颜色变浅
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH- H>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 将水加热,Kw增大,pH不变
D. 向水中加入少量CH3COOH,平衡正向移动,c(H+)增大
难度: 中等查看答案及解析
-
对下列各种溶液中所含离子的判断合理的是( )
A.向无色溶液中加氯水变橙色,溶液中可能含:SO42-、Br-、OH-、Ba2+
B.25℃时在水电离出的c(H+)=1.0×10-11mol/L的溶液中可能含:Mg2+、Cu2+、SO42-、NO3-
C.25℃时
=0.1 mol/L的溶液中可能含:Na+、K+、CO32-、NO3-
D.在c(Fe3+)=1.0mol/L的溶液中可能含:K+、Na+、SCN-、HCO3-
难度: 中等查看答案及解析
-
下列实验能达到实验目的是( )
序号
实验内容
实验目的
A
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向FeCl3+3KSCN
Fe(SCN)3+3KCl的溶液平衡体系中加入少量KCl固体
说明增加生成物浓度,平衡逆向移动
C
向盛有AgCl悬浊液的试管中滴加0.1mol·L-1NaI溶液,浊液变黄
证明相同温度下,
KSP(AgCl)>KSP(AgI)
D
酸式滴定管中硫酸液面在20.00mL,将滴定管中液体全部放出
量取20.00mL硫酸溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法中,与盐类水解有关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,将FeCl3溶于少量的浓盐酸再加水稀释;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
A.①④⑥ B.②③⑤ C.③④⑤ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25 ℃其溶度积为2.8×10-9,下列说法不正确的是

A.x数值为2×10-5 B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点 D.b点与d点对应的溶度积相等
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g) ΔH>0,(A%为A平衡时百分含量)下列图象中正确的是( )
A.
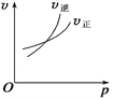 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.3C(s)+CaO(s)
CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0
B.寻找高效催化剂,使水分解产生氢气,同时释放能量
C.恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)
2NH3(g) △H=﹣aKJ/mol,平衡时向容器中再充入一定量的 NH3,重新达到平衡时 a 值减小
D.C(g)+H2O(g)
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
难度: 中等查看答案及解析
-
对下列各溶液中,微粒的物质的量浓度关系表述正确的是 ( )
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.0.1mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2mol·L-1NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25°C100mLNH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
难度: 中等查看答案及解析
-
在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
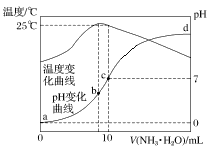
A.a点Kw=1.0×10-14
B.25 ℃时NH4Cl水解常数为(n-1)×10-7 mol·L-1
C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.水的电离程度:b>c>a>d
难度: 中等查看答案及解析

 _____________
_____________