-
化学已经渗透到人类生活的各个方面,下列说法不正确的是( )
A.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水
B.“光化学烟雾”、“臭氧空洞”、“硝酸酸雨”的形成都与氮氧化合物有关
C.低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列有关叙述正确的是 ( )
A.100 g 98%的浓硫酸中含有的氢原子数目为2NA
B.16g16O2和18O3的混合物中含有的质子数目为8NA
C.电解精炼铜的过程中,若阳极减重64g,则电路中一定通过2NA个电子
D.取50mL14.0mol/L浓硝酸与足量的铜片反应,生成气体分子的数目可能为0.25NA
难度: 中等查看答案及解析
-
“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )

A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为3mol、7 mol
D.该分子中的所有碳原子可能共平面
难度: 中等查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是( )

A.a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸
B.b图,右边试管中产生气泡较为迅速,说明氯化铁的催化效果比二氧化锰好
C.c图,根据试管中收集到无色气体,不能验证铜与稀硝酸的反应产物是NO
D.d图,试管中先有白色沉淀、后有黑色沉淀生成,能确定Ksp(AgCl) >Ksp(Ag2S)
难度: 简单查看答案及解析
-
元素X、Y、 Z、W、Q、 M在元素周期表的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是( )
X
Y
Z
W
Q
M
A. 对应氢化物的沸点Y> Q是因为Y的非金属性比Q强
B. XM4的比例模型为
 其二氢取代物有两种
其二氢取代物有两种C. W的氧化物,常温下可以和Z、M的氢化物反应
D. Z的单质能将Y的单质从他的氢化物中置换出来
难度: 中等查看答案及解析
-
有关电解质溶液的叙述正确的是
A. 向0.2mol·L-1CH3COOH溶液中加入等体积0.1 mol·L-1NaOH溶液,测得溶液中 c(CH3COO-)>c(Na+),则水的电离程度比纯水的大
B. 向0.1 mol·L-1氨水中滴加0.1 mol·L-1盐酸,刚好完全中和时溶液pH=a,则由水电离产生的c(OH-)=10a-14 mol·L-1
C. 将0.1 mol·L-1 Na2CO3和0.1 mol·L-1NaHCO3溶液等体积混合,所得溶液有:
c(CO32-)+2c(OH-)=2c(H+) + c(HCO3-) + 3c(H2CO3)
D. 对于难溶电解质:相同温度时,Ksp大的饱和溶液的物质的量浓度一定比Ksp小的饱和溶液物质的量浓度大
难度: 困难查看答案及解析
-
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
B.放电时,Li+透过固体电解质向Cu极移动
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
难度: 困难查看答案及解析


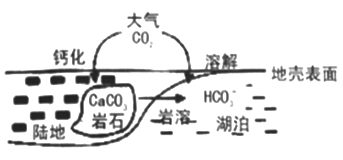
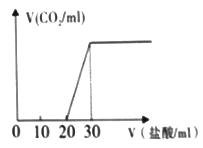
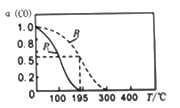
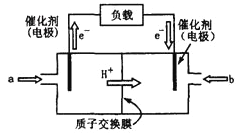




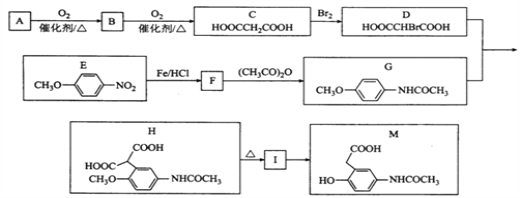

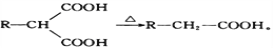
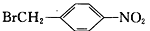 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备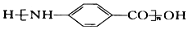 的合成路线:_______________________________________________。
的合成路线:_______________________________________________。