-
下列分别是利用不同能源发电的实例,其中不属于新能源开发利用的是( )
A.
 风力发电 B.
风力发电 B.  太阳能发电
太阳能发电C.
 火力发电 D.
火力发电 D.  潮汐能发电
潮汐能发电难度: 简单查看答案及解析
-
美国亚利桑那州大学和阿贡国家实验室的科学家最近设计出生产氢气的人造树叶,原理为2H2O(g)
2H2(g)+O2(g)。有关该反应的说法正确的是( )
A.ΔH<0 B.ΔS<0
C.化学能转变为电能 D.氢能是理想的绿色能源
难度: 简单查看答案及解析
-
反应COCl2(g)
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ
B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
难度: 中等查看答案及解析
-
少量铁粉与10mL 0.1mol·L-1的稀盐酸反应反应速率太慢。为了加快此反应速率而不改变H2的产量可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加 CHCOONa固体 ⑤加NaCl溶液⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)改10mL 1mol·L-1盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
难度: 简单查看答案及解析
-
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
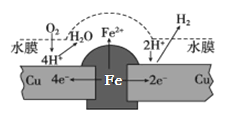
A.腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B.若水膜中溶有食盐将加快铁铆钉的腐蚀
C.若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D.若将该铜板与直流电源负极相连,则铁铜均难被腐蚀
难度: 中等查看答案及解析
-
中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、Al2Cl7-和有机阳离子组成电解质溶液,其放电工作原理如图所示。下列说法正确的是

A.放电时电子由石墨电极经用电器流向铝电极
B.充电时铝电极上发生氧化反应
C.充电时,AlCl4-向铝电极方向移动
D.放电时,负极反应为Al-3e-+7 AlCl4-═4Al2Cl7-
难度: 简单查看答案及解析
-
下列说法正确的有几个( )
(1)强电解质溶液的导电能力不一定比弱电解质溶液强
(2)将氢氧化钠溶液和氨水各稀释一倍,氢氧根浓度均减小为原来的—半
(3)如果盐酸的浓度是醋酸浓度的2倍,则盐酸的氢离子浓度也是醋酸的2倍
(4)减少反应物的用量,平衡一定逆向移动
(5)离子化合物一定是电解质
(6)非电解质的水溶液一定不能导电
A.1个 B.2个 C.3个 D.4个
难度: 中等查看答案及解析
-
下列说法对应的离子方程式合理的是
A. 纯碱溶液去油污:CO32-+H2O=HCO3-+OH-
B. 泡沫灭火器工作原理:2Al3++3CO32-+3H2O= 2A1(OH)3↓+3CO2↑
C. 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-=BaSO4↓+AlO2-+2H2O
D. 用石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2时,阳极上发生的电极反应式:Pb2++2 H2O-2e-=PbO2+4H+
难度: 困难查看答案及解析
-
下列实验操作、现象及得出的结论均正确的是
选项
实验操作
现象
结论
A
向盛有品红的两支试管中分别通入SO2和Cl2
品红均褪色
两者漂白原理相同
B
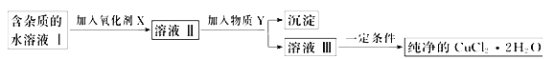
向体积相同且pH均为3.3的一元酸HX 和HY 中分别加入足量锌粒
前者产生的H2比后者多
HX、HY 均是弱酸
C
在难溶盐FeS和CuS中分别加入0.3mol/L盐酸
前者溶解,后者不溶
Ksp(FeS)>Ksp(CuS)
D
向盛有相同体积、10%H2O2溶液的两支试管中分别加人足量酸性KMnO4溶液和FeCl3溶液
前者产生的气体多
KMnO4催化活性比FeCl3高
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列各表述与示意图一致的是( )

A. ①反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. ②N2(g)+3H2(g)
2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
C. ③A(g)+B(g)
C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
D. ④2NO(g)+2CO(g)
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
难度: 中等查看答案及解析
-
苯甲酸的电离方程式为
+H+,其Ka=6.25×10-5,苯甲酸钠(
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,H2CO3的Ka1=4.17×l0-7,Ka2=4.90×l0-11。在生产碳酸饮料的过程中,除了添加NaA外, 还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
A.H2CO3的电离方程式为 H2CO3
2H++CO32-
B.提高CO2充气压力,饮料中c(A-)不变
C.当pH为5.0时,饮料中
=0.16
D.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
难度: 中等查看答案及解析
-
在15 mL0.10 mol·L-1NaOH 溶液中逐滴加入 0.20 mol·L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如下图所示,有关粒子浓度大小关系正确的是
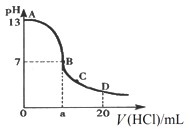
A. 在 A、B 间任意一点:c(Na+)﹥c(CN-)﹥c(OH-)﹥c(H+)
B. 在 B 点:c(Na+) = c(CN-)﹥c( OH-) = c(H+),且 a=7.5
C. 在 C 点:c(CN-)﹥c(Na+)﹥c(OH-)﹥c(H+)
D. 在 D 点:c(HCN) + c(CN-)﹥2c(Na+)
难度: 困难查看答案及解析
-
25℃时,用0.1mol·L-1的CH3COOH溶液滴定20mL0.1mol·L-1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是
A.Ka=
B.V=
C.Ka=
D.Ka=
难度: 中等查看答案及解析
-
溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:

下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
难度: 困难查看答案及解析
-
已知298K时下列物质的溶度积
CH3COOAg
AgCl
AgCrO4
AgS
Ksp
2.3×10-3
1.77×10-10
1.12×10-12
6.7×10-15
下列说法正确的是( )
A.等体积浓度均为0.02mol•L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.浓度均为0.01mol•L-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
难度: 中等查看答案及解析