-
下列实验操作正确且能达到目的的是
A.用NH4Cl溶液蒸干制备NH4Cl固体
B.用重结晶法除去KNO3中混有的NaCl
C.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
D.用NaOH溶液和分液漏斗萃取溴水中的溴
难度: 中等查看答案及解析
-
(原创)下列物质分类正确的是
A.SO2、SiO2、P2O5均为酸性氧化物
B.是否具有丁达尔效应是胶体与溶液、浊液的根本区别
C.纯净盐酸为纯净物、冰水混合物为混合物
D.烧碱、纯碱都属于碱,油脂、甘油都属于酯
难度: 简单查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
A.Z单质与氢气反应较Y剧烈
B.X与W的原子核外电子数相差9
C.X单质氧化性强于Y单质
D.最高价氧化物对应水化物酸性W比Z强
难度: 中等查看答案及解析
-
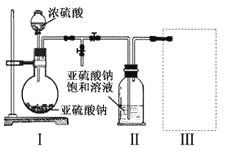
某盐溶液中可能含有NH4+、Ba2+、Na+、Fe2+、Cl—、CO32—、NO3—七种离子中的数种。某同学取4份此溶液样品,分别进行了如下实验:
①用pH试纸测得溶液呈强酸性;
②加入过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
③加入硝酸酸化的AgNO3溶液产生白色沉淀;
④加足量BaCl2溶液,没有沉淀产生,在溶液中加入氯水,再滴加KSCN溶液,显红色
该同学最终确定在上述七种离子中肯定含有NH4+、Fe2+、Cl—三种离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④ B.①② C.①②③④ D.②③④
难度: 中等查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2∶1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
难度: 中等查看答案及解析
-
已知2Al+2NaOH+2H2O=2NaAlO2+3H2↑。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
A.每生成6.72 L的H2,溶液中AlO2﹣的数目就增加0.2 NA
B.每生成0.15 mol H2,被还原的水分子数目为0.3 NA
C.当加入2.7 g Al时,转移的电子数目为0.3 NA
D.溶液中每增加0.1 mol的AlO2﹣,Na+的数目就增加0.1 NA
难度: 困难查看答案及解析
-
据报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是( )
A.O2(PtF6) 中不存在共价键
B.在此反应中每生成1mol O2(PtF6)则转移lmol电子
C.O2(PtF6)中氧元素的化合价是+l价
D.在此反应中,O2是氧化剂,PtF6是还原剂
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气
L
B.NA可表示为:
C.反应后溶液中的Cl―数目为:
D.反应后溶液中的H+数目为:
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中一定大量共存的是( )
A.饱和氯水中:Cl-、NO3-、Na+、SO32-
B.c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br-
C.甲基橙呈红色的溶液中: I-、Cl-、NO3-、Na+
D.含大量Al3+的溶液中: K+、Na+、NO3-、ClO-
难度: 中等查看答案及解析
-
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素, X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法正确的是( )
A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
B.用M单质作阳极,石墨作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀
C.化合物YW2、ZW2都是酸性氧化物
D.X、Z两元素能形成原子个数比(X:Z)为3:1和4:2的化合物
难度: 中等查看答案及解析
-
下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项
微粒组
所加试剂
离子方程式
A
NH
、Fe2+、SO
少量Ba(OH)2溶液
2NH
+SO
+Ba2++2OH-===BaSO4↓+2NH3·H2O
B
Mg2+、Cl-、HCO
过量NaOH溶液
Mg2++2HCO
+4OH-===Mg(OH)2↓+2CO
+2H2O
C
Fe2+、NO
、HSO
NaHSO4溶液
HSO
+H+===SO2↑+H2O
D
K+、CO
、NH3·H2O
通入少量CO2
CO
+CO2+2H2O===2HCO
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+、Al3+ 和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中

A.溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2 mol•L﹣1
B.原溶液中c(Fe3+)=0.2 mol•L﹣1
C.SO42﹣、NH4+、Na+一定存在,CO32﹣、Al3+一定不存在
D.取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数。下列叙述正确的是( )
A.常温下,1molNaHCO3投入足量稀盐酸中,待反应结束后,可逸出NA个CO2分子
B.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中,氢离子(H+)数目略大于NA
C.1molCH3+(碳正离子)中含电子数目为10NA
D.1mol油酸(化学式:C17H33COOH)含有的双键数目为NA
难度: 中等查看答案及解析
-
下列物质的检验,其结论一定正确的是
A.向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42—
B.向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32— 或SO32—
C.取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化
D.能使湿润的碘化钾淀粉试纸变蓝的一定是Cl2
难度: 简单查看答案及解析
-
在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O
HSO3-十OH— B.HSO3-十H2O
H2SO3十OH-
C.HSO3-十OH—
SO32—十H2O D.H2SO3+OH-
HSO3-十H2O
难度: 中等查看答案及解析
-
下列实验操作、现象和发生的离子反应完全正确的是( )
实验操作
现象
发生的离子反应
A
向BaCl2 溶液中通入CO2
溶液浑浊
Ba2++ CO2+H2O=== BaCO3↓+2H+
B
向NaAlO2溶液中通入过量CO2
溶液浑浊
AlO2- + CO2+2H2O === Al(OH)3↓+ HCO3-
C
将可调高度的铜丝伸入到稀HNO3中
溶液变蓝
Cu+4H++2NO3-=== Cu2++2NO2↑+2H2O
D
将Cl2通入KI溶液中,加入CCl4,振荡,静置
上层溶液显紫红色
Cl2 +2I-=== 2Cl- + I2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某含Cr2O72-废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到nmolFeO•FeyCrxO3(提示:其中Cr为+3价)。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B.处理废水中Cr2O72-的物质的量为(nx/2)mol
C.反应中发生转移的电子的物质的量为6nxmol
D.在FeO•FeyCrxO3中3x=y
难度: 中等查看答案及解析