-
下列有关热化学方程式的叙述正确的是
A. 已知甲烷的燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知中和热为ΔH=-57.3 kJ/mol,则1 mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D. 已知S(g)+O2(g)=SO2(g) ΔH1;S(s)+O2(g)=SO2(g) ΔH2,则ΔH1<ΔH2
难度: 中等查看答案及解析
-
分类是化学学习与研究的常用方法,下列分类正确的是( )
A.Cl2O7、P2O5、SO3、CO2均属于酸性氧化物
B.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
难度: 简单查看答案及解析
-
化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的有( )
①用电子式表示HCl的形成过程:
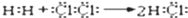
②MgCl2的电子式:
③质量数为133、中子数为78的铯原子:
Cs
④S2﹣的结构示意图:
⑤次氯酸分子的结构式:H-O-Cl
⑥ CO2的分子比例模型示意图:
A.2个 B.3个 C.4个 D.5个
难度: 简单查看答案及解析
-
下列各组物质相互混合进行反应,既有气体最终又有沉淀生成的是 ( )
①金属钠投入FeCl2溶液中 ②过量的NaOH溶液和明矾溶液反应
③少量CaO投入到过量的NaHCO3溶液中 ④Na2O2投入到CuSO4溶液中
A.①③ B.③④ C.②③ D.①④
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.用过量氨水吸收工业尾气中的SO2: 2NH3·H2O+SO2===2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-===CaCO3↓+CO32-+2H2O
C.磁性氧化铁溶于足量稀硝酸: Fe3O4+8H+===Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-===2BaSO4↓+Al(OH)3↓
难度: 中等查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中,不正确的是
A.a = 4 B.Y的化学式为Fe2O3
C.S2O32-是还原剂 D.每有1molO2参加反应,转移的电子总数为4mol
难度: 中等查看答案及解析
-
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为20 L,Z的平衡浓度变为原来的
C. 以X的浓度变化表示的反应速率为0.001 mol/(L·s)
D. 若升高温度,X的体积分数增大,则该反应的ΔH >0
难度: 中等查看答案及解析
-
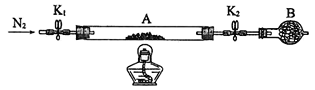
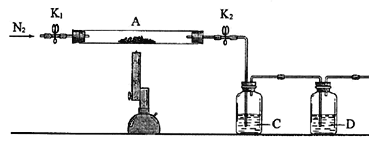
下列实验方案不能达到实验目的的是
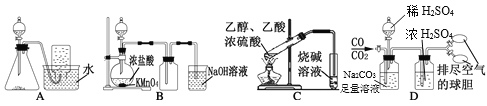
A.图A装置Cu和浓硝酸制取NO B.图B装置实验室制备Cl2
C.图C装置实验室制取乙酸乙酯 D.图D装置实验室分离CO和CO2
难度: 中等查看答案及解析
-
类推的思维方法可解决不少化学问题,但类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,你认为正确的是( )
A.沸点HBr>HCl,则同族元素氢化物沸点HCl>HF
B.Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3
C.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2
D.惰性电极电解硫酸溶液后,加水可以使电解质溶液完全恢复。则用惰性电极电解硫酸钠溶液后加水也可以使电解质溶液完全恢复
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D、E原子序数依次增大,其中A、B、D同主族,C、E同主族,A元素最高正化合价与最低负化合价代数和为零,E是太阳能转化为电能的常用材料,则下列说法正确的是( )
A.由A、D两种元素组成的化合物中只含有离子键
B.C、E的最高价氧化物具有相似的物理性质和化学性质
C.微粒半径大小:B+>A-
D.最高价氧化物对应水化物碱性强弱:B>D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法中正确的是 ( )
①46g NO2和N2O4的混合气体中含有的原子个数为3NA
②常温下,4 g CH4含有NA个C-H共价键
③10 mL质量分数为98%的H2SO4,加水至100 mL,H2SO4的质量分数为9.8%
④标准状况下,5.6L四氯化碳含有的分子数为0.25NA
⑤25 ℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA
⑥1 mol Na2O2与水完全反应时转移电子数为2NA
A.①②④ B.①②⑤ C.③⑤⑥ D.④⑤⑥
难度: 困难查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是 ( )
①pH = 0的溶液:Na+、C2O42-、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度c(H+)=10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
A.①④ B.①② C.②⑤ D.②④
难度: 中等查看答案及解析
-
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是
A.由水电离的c(H+):①=②>③=④
B.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>①>②
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
难度: 中等查看答案及解析
-
常温下,向100 mL 0.1 mol·L-1 HA溶液中逐滴加入0.2 mol·L-1 MOH溶液,所得溶液的pH变化曲线如图所示。下列有关说法正确的是 ( )
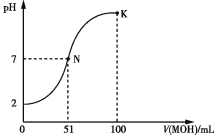
A.HA的电离方程式:HA
H++A-
B.N点、K点水的电离程度:N<K
C.N点溶液中:c(A-)=c(M+)=c(H+)=c(OH-)
D.K点溶液中:c(OH-)+c(MOH)+c(A-)-c(H+)=0.1 mol·L-1
难度: 困难查看答案及解析
-
根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
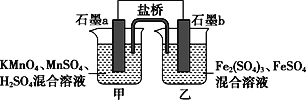
A.石墨b是原电池的负极,发生氧化反应
B.甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C.电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D.忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),
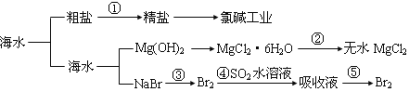
下列有关说法正确的是 ( )
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.工业上金属钠是通过氯碱工业制取
C.在第③④⑤步中溴元素均被氧化
D.从第③步到第⑤步的目的是为了浓缩
难度: 中等查看答案及解析
-
在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)
NaNO3(s)+ClNO(g) △H1<0平衡常数K1
②2NO(g)+Cl2(g)
2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(L·min)。下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
难度: 中等查看答案及解析
-
某溶液中可能含有H+、
、Mg2+、Al3+、Fe3+、
、
、
中的几种。
①若加入锌粒,用排空气法收集到无色无味气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是( )
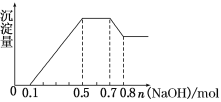
A.溶液中的阳离子有H+、Mg2+、Al3+、
B.溶液中n(Mg2+)=0.1 mol
C.溶液中一定不含
、
、Fe3+
D.n(
∶n(Al3+)∶n(Mg2+)=4∶2∶1
难度: 中等查看答案及解析
-
在密闭容器中充入CO2、CO、CH4的混合气体共m g,若加入足量Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加m g,则CO2与CH4的体积比为( )
A.3∶1 B.2∶1 C.1∶1 D.任意比
难度: 简单查看答案及解析
-
将11.9g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g。另取等质量的合金溶于过量稀硝酸中,生成了6.72LNO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
A.22.1g B.27.2g C.30g D.30.2g
难度: 中等查看答案及解析