-
用4×10-3 mol的KZO4 恰好将60 mL 0.1 mol/L的Na2SO3溶液氧化为Na2SO4,则元素Z在还原产物中的化合价是
A. +6 B. +4 C. +3 D. +2
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列说法不正确的是
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“青蒿一握,以水二升渍,绞取汁”,诗句中屠呦呦对青蒿素的提取属于化学变化
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
难度: 简单查看答案及解析
-
下列物质所属类别正确的一组是( )
A.混合物:空气、水煤气、碱石灰
B.碱性氧化物:氧化钙、过氧化钠、氧化铝
C.四大基本反应类型:化合、分解、置换、氧化还原
D.正盐:氯化钠、碳酸氢钠、碱式碳酸铜
难度: 中等查看答案及解析
-
同温同压下,A容器中HCl与B容器中NH3所含原子数相等,这两容器的体积之比为( )
A.1:4 B.4:1 C.1:2 D.2:1
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 molNaHCO3与足量盐酸反应放出CO2气体的体积为22.4L
B.1 mol Al3+离子含有的核外电子数为3NA
C.7.8g过氧化钠与足量水反应,转移电子数为0.1NA
D.O2和O3的混合气体,质量为48g,所含氧原子数为1.5 NA
难度: 简单查看答案及解析
-
收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是( )
A.铝不易被氧化
B.铝的氧化物在空气中易变成铝
C.铝的密度小,是一种轻金属
D.铝易被氧化,形成的氧化膜有保护作用
难度: 简单查看答案及解析
-
下列离子方程式的书写不正确的是( )
A.氧化铁溶于盐酸Fe2O3+6H+═2Fe3++3H2O
B.Na2CO3溶液滴入少量盐酸CO32﹣+H+═HCO3﹣
C.Na与FeSO4溶液反应:2Na + Fe2+ ═ Fe + 2Na+
D.AlCl3溶液滴入氨水 Al3++3NH3•H2O═Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
选项
实验操作
现象
结论
A
分别加热Na2CO3和NaHCO3固体
试管内壁均有水珠
两种物质均受热分解
B
将铜粉加入1.0mol/L Fe2(SO4)3溶液中
溶液变蓝,有黑色固体出现
金属铁比铜活泼
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D
向硫酸铝溶液中加入足量氨水
有白色沉淀生成
氢氧化铝不溶于过量氨水
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有关焰色反应的说法正确的是( )
A. 焰色反应是金属单质表现的性质
B. 焰色反应是因为发生了化学变化而产生
C. 焰色反应看到黄色火焰并不能确定该物质一定不含钾元素
D. 可用稀硫酸代替稀盐酸洗涤焰色反应中用到的铂丝
难度: 中等查看答案及解析
-
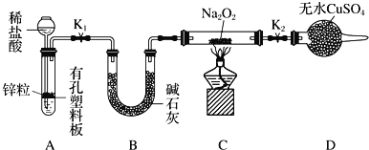
下列图示实验操作,能达到目的的是( )
A.检验钾离子
 B.干燥氯气
B.干燥氯气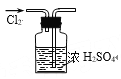 C.分离酒精与水
C.分离酒精与水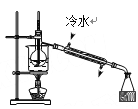 D.蒸发食盐水
D.蒸发食盐水
难度: 简单查看答案及解析
-
在相同的温度和压强下,二氧化碳和笑气(N2O)的体积相同,则下列一定相同的是
①分子数 ②原子数 ③密度 ④质量 ⑤物质的量
A.只有①⑤ B.只有①②④⑤ C.只有②③④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
配制450mL 0.1mol/L NaOH溶液,下列有关配制实验的叙述正确的是( )
A.需要称量2.0g的固体氢氧化钠
B.将称量的氢氧化钠直接先倒入容量瓶,再加入蒸馏水至刻度线,摇匀
C.该实验所需仪器有:500mL容量瓶、烧杯、玻璃棒、托盘天平
D.定容时仰视刻度,所配溶液浓度偏大
难度: 简单查看答案及解析
-
某无色溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )
A.Na+、Al3+、NO3-、Cl- B.K+、Na+、Cl-、SO42-
C.MnO4-、K+、SO42-、Cl- D.Na+、HCO3-、K+、NO3-
难度: 简单查看答案及解析
-
下列关于电解质、非电解质的说法正确的是
A.氯气溶于水得氯水,该溶液能导电,因此氯气是电解质
B.CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质
C.导电能力弱的溶液肯定是弱电解质的溶液
D.HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质
难度: 中等查看答案及解析
-
在反应 3Cl2+6KOH
KClO3+5KCl+3H2O 中,下列说法正确的是:( )
①Cl2是氧化剂,KOH是还原剂 ②KCl是还原产物,KClO3是氧化产物 ③反应中每消耗3 mol Cl2分子中有5mol 电子发生转移 ④被氧化与被还原的氯原子物质的量之比为5∶1
A.①④ B.②③ C.②③④ D.②④
难度: 中等查看答案及解析
-
关于Na2CO3 与NaHCO3的性质判断正确的是
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度盐酸反应的剧烈程度:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
难度: 中等查看答案及解析
-
下列各组溶液,不能通过互滴鉴别的是( )
A.碳酸钠溶液和盐酸 B.碳酸氢钠溶液和氢氧化钙溶液
C.硫酸铝和氢氧化钠溶液 D.偏铝酸钠溶液和硫酸
难度: 中等查看答案及解析
-
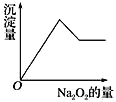
将等物质的量的NaOH和Na2CO3混合并配成溶液,向溶液中逐滴滴加稀盐酸,下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
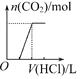
B.
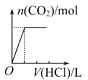
C.
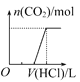
D.
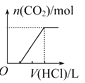
难度: 中等查看答案及解析
-
某溶液中只含有Al3+、Na+、Cl-、SO42-四种离子,已知前三种离子的个数比为3:2:1,则溶液中Na+和SO42-的离子个数比为
A.1:2 B.2:5 C.3:1 D.1:10
难度: 中等查看答案及解析
-
根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的是
①2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
②2FeCl3+2KI==2FeCl2+2KCl+I2
③2FeCl2+Cl2=2FeCl3
A.MnO4->Cl2>Fe3+>I2 B.Cl->Mn2+>I->Fe2+
C.MnO4-> Cl2>I2>Fe3+ D.I->Fe2+>Cl->Mn2+
难度: 中等查看答案及解析