-
能在溶液中大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后仍能大量存在的离子组是( )
A.Na+、H+、Cl-、NO3-
B.K+、Ba2+、OH-、I-
C.Na+、Mg2+、Cl-、SO42-
D.Cu2+、S2-、Br-、ClO-难度: 中等查看答案及解析
-
分类法是一种行之有效、简单易行的科学方法.某同学用下表所示形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系.下列各组中,有错误的组合是( )
选项 甲 乙、丙、丁 A 常见干燥剂 浓硫酸、无水氯化钙、碱石灰 B 常见合金 不锈钢、硬铝、生铁 C 分子晶体 CO2、SiO2、H2O D 强电解质 HCl、Na2O、BaSO4
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列说汉正确的是( )
A.H、D、T属于同位素,H2、D2、T2属于同素异形体
B.氯水、氨水、王水是混合物,水银、水玻璃是纯净物
C.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质
D.水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源难度: 中等查看答案及解析
-
对相同状况下的12C18O和14N2两种气体,下列说法正确的是( )
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等难度: 中等查看答案及解析
-
下列分析推断有错误的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量较低
B.某温度下,向饱和食盐水中通入HCl气体没有明显的现象发生
C.当反应物的总能量小于生成物的总能量时,反应物需要吸收能量才能转化为生成物
D.将外形不规则的胆矾晶体投入饱和硫酸铜溶液中,通过观察晶体外形的变化而晶体质量保持不变,能证明溶解平衡是一个动态平衡难度: 中等查看答案及解析
-
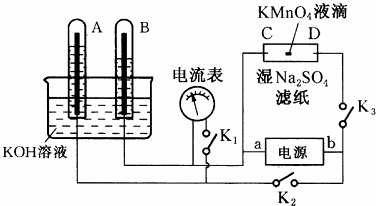
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池.电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-
④电池放电后,溶液pH不断升高.
A.①②
B.①③
C.①④
D.③④难度: 中等查看答案及解析
-
接触法生产H2SO4的过程中,对废气、废液、废渣和“废热”的处理正确的是( )
①尾气用氨水处理 ②污水用石灰乳处理③废渣用来炼铁、制水泥等④将“废热”通过“废热”锅炉产生蒸气发电.
A.只有①②
B.只有①③④
C.只有①②③
D.全部难度: 中等查看答案及解析
-
设NA为阿伏加德岁常数的值,下列叙述中正确的是( )
(1)1molNa2O2中含有的离子数为4NA
(2)6.0克SiO2晶体中含有0.2NA 个Si一O键
(3)常温常压下,3.2克O3所含原子数为0.2NA
(4)标准状况下,2.24LCl2与氢氧化钠完全反应转移电子0.2NA
(5)7.8克Na2O2与CO2完全反应转移电子0.2NA
(6)2克NO2和44克N2O4的混合气体所含原子数为3NA.
A.2个
B.3个
C.4个
D.5个难度: 中等查看答案及解析
-
如图所示,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应.供选择的物质有:a.铁;b.稀H2SO4;c.Na2CO3溶液;d.BaCl2溶液;e.Cu(NO3)2溶液;f.MgSO4溶液.图中编号④代表的物质是( )
A.H2SO4
B.MgSO4
C.Cu(NO3)2
D.BaCl2难度: 中等查看答案及解析
-
下列现象或事实可用同一原理加以解释和说明的是( )
A.氯化铵和碘都可以用加热法进行提纯
B.浓硫酸和浓盐酸长期暴露在空气中浓度降低
C.硫酸亚铁溶液和氢氧化钠溶液在空气中久置后均会变质
D.二氧化硫气体能使高锰酸钾溶液和溴水褪色难度: 中等查看答案及解析
-
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2 ②Cl2 ③CH4 ④HCl⑤NH3 ⑥NO ⑦NO2 ⑧SO2,下列操作正确的是( )
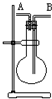
A.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
B.烧瓶是干燥的,由A进气收集①③⑤
C.在烧瓶中充满水,由A进气收集①③⑤⑦
D.在烧瓶中充满水,由B进气收集⑥难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )
A.NH4CuSO3中硫元素被氧化
B.该反应显示硫酸具有酸性
C.刺激性气味的气体是氨气
D.该反应中硫酸作氧化剂难度: 中等查看答案及解析
-
以葡萄糖为燃料的微生物燃料电池如图所示.关于该电池的叙述正确的是( )

A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6 H2O-24e-=6CO2↑+24H+
C.放电过程中,将不断的产生H+,为了保持电解质浓度恒定,要定期向装置中加入适量的NaOH溶液
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO244.8L难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O
+O2+xOH-═Fe3O4+S4O
+2H2O下列说法中,正确的是( )
A.每生成1mol Fe3O4,反应转移的电子总数为3mol
B.Fe2+和S2O都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为mol
D.x=6难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.NaHSO4溶液与少量Ba(OH)2溶液混合:Ba2++OH+SO42-+H+=BaSO4↓+H2O
B.向硝酸银溶液中加入过量氨水:Ag++NH3•H2O=AgOH↓+NH4+
C.向NH4HSO3溶液中滴加过量的氢氧化钡溶液NH4++HSO3-+Ba2++2OH-=BaSO3↓+NH3•H2O+H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=H++Cl-+HSO4-难度: 中等查看答案及解析
-
下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)( )
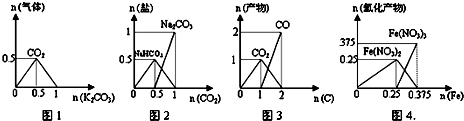
A.图1:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐
C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物
D.图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)难度: 中等查看答案及解析