-
下列各组物质之间的转化不是全部通过一步反应完成的是( )
A.Na→NaOH→Na2CO3→NaCl B.Al→Al2O3→Al(OH)3→AlCl3
C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
难度: 中等查看答案及解析
-
下列由实验得出的结论正确的是
实验
结论
A.
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2-二溴乙烷无色、可溶于四氯化碳
B.
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C.
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D.
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的氯甲烷具有酸性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质分类正确的是( )
A.Na2O2、Fe3O4、CuO均为碱性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.盐酸、水玻璃、氨水均为混合物
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 次氯酸的结构式:H-Cl-O B. 氢氧根离子的电子式:
C. S2-的结构示意图:
D. 中子数为146、质子数为92的铀(U)原子:
难度: 中等查看答案及解析
-
俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C
Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol·L-1的Na2SO4溶液中含SO42-的数目为0.1NA
B. 1 mol 13C原子所含中子数为6NA
C. 78 g Na2S中所含离子总数为2NA
D. 标准状况下,2.24 L CO2所含氧原子数为0.2NA
难度: 中等查看答案及解析
-
下列关于物质性质的比较,不正确的是
A.金属性强弱:Na>Mg>Al B.碱性强弱:KOH>NaOH>LiOH
C.原子半径大小:Na>S>O D.酸性强弱:HIO4>HBrO4>HClO4
难度: 简单查看答案及解析
-
下列对熵的理解不正确的是( )
A.同种物质气态时熵值最大,固态时熵值最小
B.体系越有序,熵值越小;越混乱,熵值越大
C.与外界隔离的体系,自发过程将导致体系的熵减小
D.25 ℃、1.01×105Pa时,2N2O5(g)=4NO2(g)+O2(g)是熵增的反应
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g) ΔH>0,下列图像中正确的是( )
A.
 B.
B.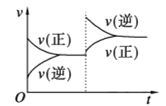
C.
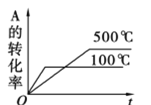 D.
D.
难度: 简单查看答案及解析
-
下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是
A. N2(g)+3H2(g)
2NH3(g) ΔH<0
B. N2(g)+O2(g)
2NO(g) ΔH>0
C. C(s)+2H2O(g)
CO2(g)+2H2(g) ΔH>0
D. 2SO2(g)+O2(g)
2SO3(g) ΔH<0
难度: 简单查看答案及解析
-
物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )
A. 两溶液加入等质量的锌粉,产生氢气的速率相同
B. 两溶液中氢氧根离子浓度均为
C. 加入醋酸钠固体,二者的pH均增大
D. 恰好完全反应时,两溶液消耗等浓度等体积的氢氧化钠
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-;DH>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,KW增大,pH不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
难度: 中等查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2CO3溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HCO3-)+c( CO32-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
难度: 中等查看答案及解析
-
某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是
A.AgCl的溶解度、Ksp均减小 B.AgCl的溶解度、Ksp均不变
C.AgCl的溶解度减小、Ksp不变 D.AgCl的溶解度不变、Ksp减小
难度: 中等查看答案及解析
-
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
难度: 中等查看答案及解析