-
有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
(1)25℃时,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是_____________(用离子方程式表示);
(2)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”);
(3)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-) b.NH4+水解是微弱的
c.NH3·H2O是弱碱 d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(5)某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是____,
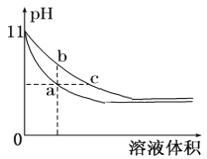
A.a点导电能力比b点强
B.b点的KW值大于c点
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.a、c两点c(H+)相等
-
有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
(1)25℃时,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是_____________(用离子方程式表示);
(2)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”);
(3)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-) b.NH4+水解是微弱的
c.NH3·H2O是弱碱 d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(5)某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是____,
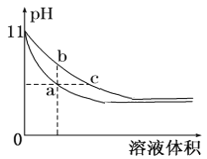
A.a点导电能力比b点强
B.b点的KW值大于c点
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.a、c两点c(H+)相等
-
有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3
(1)25℃时,用离子方程式表示 0.1mol·L-1②溶液的酸碱性原因:__________ ;
(2)常温下,0.1mol/L的③和⑥溶液中微粒(含离子和分子)的种类是否相同:_______ (填“相同”或“不相同”);
(3)将④溶液加热蒸干并灼烧最终得到的物质是________ (填化学式);
(4)常温下 0.1 mol/L⑤溶液加水稀释至中性的过程中,下列表达式的数据一定变大的是_______。
A.c(H+) B.c(OH-) C. D.c(H+)·c(OH-)
D.c(H+)·c(OH-)
-
有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3
(1)25℃时,0.1mol·L-1①溶液呈______性,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是______________________________________(用离子方程式表示);
(2)常温(填“>”、“=”或“<”)下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”),溶液的pH:③_________⑥(填“>”、“=”或“<”);
(3)将④溶液加热蒸干并灼烧最终得到的物质是____________(填化学式);
(4)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.  C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
-
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S D.NH4Cl (NH4)2SO4 Na2S NaNO3
-
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
-
物质的量浓度相同的下列溶液中,符合按pH由小到大排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
-
物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S D.NH4Cl (NH4)2SO4 Na2S NaNO3
-
有下列六种物质的溶液:①Na2CO3 ②Al2(SO4)3 ③CH3COOH ④NaHCO3 ⑤HCl ⑥Al(OH)3
(1)pH值相同的③和⑤,分别用蒸馏水稀释至原来的 倍和
倍和 倍,稀释后两溶液的
倍,稀释后两溶液的 值仍然相同,则
值仍然相同,则 ______
______ (填“<”或“>”或“=”)
(填“<”或“>”或“=”)
(2)室温下, 值为11的①溶液中,由水电离出来的c(OH—)=______
值为11的①溶液中,由水电离出来的c(OH—)=______
(3)写出①溶液的电荷守恒:____________。
(4)写出⑥的酸式电离方程式:________________
(5)用②和④的溶液可以制作泡沫灭火剂,其原理为:________________(用离子方程式解释)
(6)已知反应NH4++HCO3-+H2O⇌NH3·H2O+H2CO3,该反应平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
-
有下列七种物质的溶液:
①NaCl ②NH4Cl ③Na2CO3 ④CH3COONa ⑤CH3COOH ⑥NaHCO3
(1)溶液呈酸性的有__________,呈碱性的有____________,呈中性的有_____________。(填序号)
(2)写出②④水解的离子方程式:________________________、______________________
(3)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类______(填相同或是不相同),溶液的PH:③_____⑥(填 >、=或 <)。
(4)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B. c(CH3COO-)/c(CH3COOH) C.c(H+)·c(OH-)

