-
能源家族成员:①石油 ②电力 ③风能 ④天然气 ⑤水煤气 ⑥氢能, 其中属于二次能源的有
A.① ③ ⑥ B.② ④ ⑤ C.① ③ ④ D.② ⑤ ⑥
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是 ( )
A.H2O的电子式:
B.质量数为14的碳原子:
C.CO2的比例模型:
 D.Cl-的结构示意图:
D.Cl-的结构示意图:
难度: 中等查看答案及解析
-
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能为 ( )
A.X+32 B.X+4 C.X+8 D.X+18
难度: 中等查看答案及解析
-
运用元素周期律分析下面的推断,其中错误的是 ( )
A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体
B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性
C.硫酸锶(SrSO4)是难溶于水和盐酸的的白色固体
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
难度: 中等查看答案及解析
-
最近韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬时凝固形成了“暖冰”。下列说法正确的是 ( )
A.“暖冰”中水分子上的3个原子位于同一条直线上
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
D.水是一种非常稳定的化合物,这是由于氢键所致
难度: 中等查看答案及解析
-
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y的少6个。下列说法中不正确的是( )
A.X的单质固态时为分子晶体 B.Y的单质可以形成原子晶体
C.X与Y形成的化合物固态时为分子晶体 D.X与碳形成的化合物为分子晶体
难度: 中等查看答案及解析
-
对于可逆反应A(g)+3B(s)
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·s-1
难度: 中等查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是 ( )
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
难度: 中等查看答案及解析
-
下列有关电池的叙述正确的是 ( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池工作时氢气在负极被氧化
C.太阳能电池的主要材料是高纯度的二氧化硅
D.氢氧燃料电池可将热能直接转变为电能
难度: 简单查看答案及解析
-
已知X、Y、Z都是短周期元素,它们的原子序数依次增大,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
A.Y和Z可以组成一种Y和Z的质量比为7∶8的化合物
B.X、Y、Z可以组成一种盐
C.X和Z可以组成原子个数比分别为1∶1和2∶1常温下呈液态的两种化合物
D.由X、Y、Z三种元素中的任意两种组成的10电子微粒只有2种
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.原子最外层电子数为2的元素一定处于周期表ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5
C.离子化合物中不可能存在共价键
D.金属元素与非金属元素形成的化合物一定是离子化合物
难度: 中等查看答案及解析
-
最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为 ( )
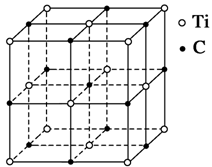
A.Ti14C13 B.TiC C.Ti4C4 D.Ti4C3
难度: 中等查看答案及解析
-
对反应A+B
AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是 ( )
A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④
难度: 中等查看答案及解析
-
X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )
A.
×100% B.
×100% C.
×100% D.
×100%
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是 ( )
A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+
O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
难度: 中等查看答案及解析
-
已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g) ===2H2O(g) ΔH=-Q2 ②
H2O(g) ===H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为 ( )
A.4Q1+0.5Q2+9Q3 B.4Q1+0.5Q2 C.4Q1+Q2+10Q3 D.4Q1+2Q2
难度: 中等查看答案及解析
-
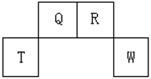
相同材质的铁在下图中的四种情况下最不易被腐蚀的是 ( )




A B C D
难度: 中等查看答案及解析
-
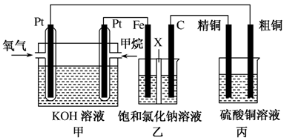
分析下图所示的四个原电池装置,其中结论正确的是 ( )
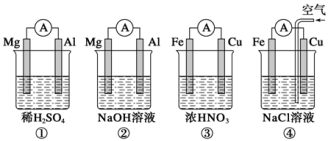
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.④中Cu作正极,电极反应式为2H++2e-=H2↑
难度: 中等查看答案及解析
-
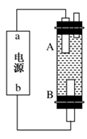
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是 ( )

A.铜棒为正极,其电极反应式为:2H++2e-====H2↑
B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出
C.反应中消耗锌的质量为13 g
D.导线中通过电子的物质的量为0.2 mol
难度: 中等查看答案及解析
-
(9分)在2 L密闭容器内,800℃时反应2SO2(g)+O2(g)
2SO3(g)体系中,n(SO2)随时间的变化如下表:
时间(s)
0
1
2
3
4
5
n(SO2)(mol)
0.020
0. 010
0.008
0.007
0.007
0.007
(1)上述反应________(填“是”或“不是”)可逆反应,在第 5 s时,SO2的转化率为________;
(2)如图所示,表示SO3变化曲线的是_____,用O2表示从0 s~2 s内该反应的平均速率:v=__;

(3)能说明该反应已达到平衡状态的是________。
a.v(SO3)=2v(O2) b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
难度: 中等查看答案及解析