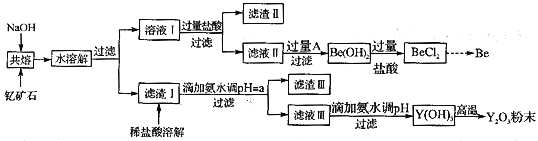
-
化学与人类的生产、生活密切相关,下列说法正确的是 ( )
A.研发使用高效催化剂,可提高反应中原料的转化率
B.“煮豆燃豆萁,豆在釜中泣”涉及的能量变化主要是化学能转化为光能和热能
C.纯碱是焙制糕点所用的发酵粉的主要成分之一,也可用纯碱除去物品表面的油污
D.向汽油中添加乙醇后,该混合燃料的热值不变
-
NA代表阿伏加德罗常数的值。下列说法正确的是 ( )
A.25℃时pH=12的KOH溶液中含有OH-的数目为0.01NA
B.用惰性电极电解饱和氯化钠溶液,阴极放出22.4 L H2,转移电子数目为2NA
C.1 L 0.1 mol/L的Na3PO4溶液中,所含 的数目小于0.1NA
的数目小于0.1NA
D.电解精炼铜,阳极溶解铜6.4 g时,阴极得电子数目为0.2NA
-
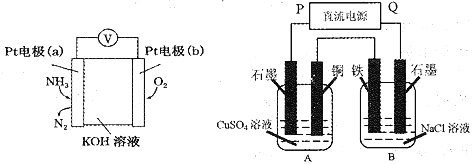
2018年10月24日港珠澳大桥正式通车,大桥设计寿命为120年,中科院对桥体钢构件采用了多种防腐方法。下列有关说法错误的是 ( )
A.钢构件表面喷涂环氧树脂涂层,可以隔绝空气、水等,防止形成原电池
B.使用防止钢筋锈蚀的海工混凝土
C.用导线将钢构件与电源负极相连
D.用导线将钢构件与铜片相连
-
在恒温恒容的密闭容器中发生反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0,下列能说明该反应达到平衡状态的是 ( )
4NO(g)+6H2O(g) ΔH<0,下列能说明该反应达到平衡状态的是 ( )
①反应速率5v(NH3)=4v(O2) ②体系的压强不再发生变化 ③混合气体的密度不再发生变化 ④气体的平均摩尔质量不再发生变化 ⑤单位时间内生成5 mol O2,同时断裂12 mol O—H键 ⑥NO的浓度不变
A.②④⑥ B.①②④⑥ C.②⑤⑥ D.①②③④⑤
-
将稀盐酸与等体积、等浓度的氨水混合后,溶液中有关离子的浓度应满足的关系是 ( )
A. B.
B.
C. D.
D.
-
下列事实能证明HCN为弱酸的是 ( )
①等体积等浓度的HCN和HCl分别与足量的锌反应,产生等量的氢气
②用HCN溶液做导电实验,灯泡很暗
③镁粉与一定量稀硫酸反应,如果向其中加入少量NaCN固体可以降低反应速率
④常温下,0.1 mol/L HCN溶液的pH小于7
⑤pH=1的HCN溶液稀释至100倍,pH约为2.8
⑥温度升高,溶液的导电能力增强
A.③⑤⑥ B.④⑤⑥ C.①③⑤ D.全部
-
下列事实中不能用勒夏特列原理解释的是 ( )
A.实验室用排饱和食盐水的方法收集氯气
B.对反应H2(g)+I2(g) 2HI(g),加压后气体颜色变深
2HI(g),加压后气体颜色变深
C.FeS不溶于水,但能溶于稀盐酸中
D.合成氨工业使用高压以提高氨气的产量
-
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,将AgCl与AgI的饱和溶液等体积混合,再向混合液中加入足量的浓硝酸银溶液,充分反应,下列说法正确的是 ( )
A.混合液中只有AgI沉淀生成
B.混合液中生成AgI沉淀少于AgCl沉淀
C.常温下,AgCl在NaCl溶液中的溶解度与在纯水中的溶解度相同
D.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小
-
25℃时,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随 的变化关系如图所示,下列叙述不正确的是 ( )
的变化关系如图所示,下列叙述不正确的是 ( )
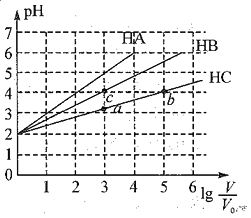
A.HA为强酸 B.若三溶液无限稀释,则它们的c(H-)近似相等
C.当 时,c(A-)大于c(B-) D.HC的电离程度:b点大于a点
时,c(A-)大于c(B-) D.HC的电离程度:b点大于a点
-
下列有关热化学方程式的叙述正确的是 ( )
A.已知S(s)+O2(g) SO2(g) ΔH1;S(g)+O2(g)
SO2(g) ΔH1;S(g)+O2(g) SO2(g) ΔH2,则ΔH1<ΔH2
SO2(g) ΔH2,则ΔH1<ΔH2
B.含20g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀NaOH溶液和稀醋酸反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D.已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ/mol,将2 mol SO2与足量的氧气混合,达平衡时,放出热量小于196. 6 kJ
2SO3(g) ΔH=-196.6 kJ/mol,将2 mol SO2与足量的氧气混合,达平衡时,放出热量小于196. 6 kJ
-
对反应aA(g) bB(g)+cC(g),向密闭容器中充入1 mol A,达平衡时,体系中B的体积分数随温度、压强的变化关系如右图所示,下列判断正确的是 ( )
bB(g)+cC(g),向密闭容器中充入1 mol A,达平衡时,体系中B的体积分数随温度、压强的变化关系如右图所示,下列判断正确的是 ( )
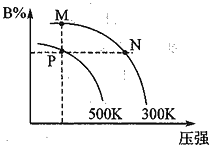
A.ΔH<0,ΔS<0
B.M、N两点的化学平衡常数:M>N
C.P、M两点A的转化率:P<M
D.保持恒温恒容,向P点再充入少量A,达新平衡时,B%增大
-
在密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g) ΔH<0,达平衡后,为提高该反应的速率同时增大N2的转化率,下列采取的措施可行的是 ( )
2NH3(g) ΔH<0,达平衡后,为提高该反应的速率同时增大N2的转化率,下列采取的措施可行的是 ( )
A.降低温度 B.恒容条件下充入稀有气体 C.加入催化剂 D.缩小容器的体积
-
常温下,几种弱酸的电离常数如下;
| 弱酸 | HF | CH3COOH | H2C2O4 |
| 电离常数(25℃) | 6.6×10-4 | 1.8×10-5 | K1=5.4×10-2 K2=5.4×10-5 |
25℃时,下列说法正确的是 ( )
A.pH相同的NaF、CH3COONa、Na2C2O4三种溶液,所含溶质的物质的量浓度为c(NaF)<c(Na2C2O4)<c(CH3COONa)
B.将HF溶液与Na2C2O4溶液混合,不发生化学反应
C.将V1亳升pH=3的CH3COOH溶液与V2毫升pH=11的NaOH溶液混合,所得溶液c(Na+)<c(CH3COO-),则V1一定大于V2
D.将等体积、等浓度的Na2C2O4溶液与NaHC2O4溶液混合,所得溶液中一定存在

-
下列实验操作正确的是 ( )
A.测定中和热
B.验证温度对化学平衡的影响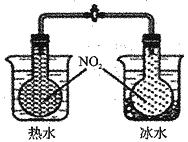
C.配制酸碱中和滴定的标准液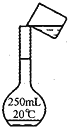
D.组装铜锌原电池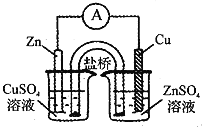
-
已知常温下,硫化物的沉淀在溶液中达溶解平衡时,金属阳离子的浓度随S2-浓度的变化曲线如图所示。据图判断,下列说法错误的是 ( )
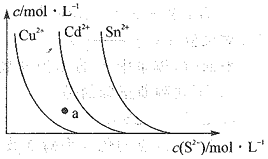
A.三种物质的溶度积大小为Ksp(CuS)<Ksp(CdS)<Ksp(SnS)
B.向SnS悬浊液中加入少量CuSO4固体,c(Sn2+)会减少
C.a点无CdS沉淀产生
D.向含等物质的量浓度的Cu2+、Sn2-的混合液中,滴加Na2S溶液,先析出CuS沉淀
-
向三个体积均为3 L的恒容绝热容器中,按不同方式投入反应物,500℃条件下开始发生如下反应:H2(g)+Br2(g) 2HBr(g) ΔH<0,测得达平衡时有关数据如下:
2HBr(g) ΔH<0,测得达平衡时有关数据如下:
| 容器 | Ⅰ | Ⅱ | Ⅲ |
| 反应物投入量 | 1 mol H2、1 mol Br2 | 2 mol HBr | 2 mol H2、2 mol Br2 |
| 平衡时正反应速率 | v1 | v2 | v3 |
| 平衡常数 | K1 | K2 | K3 |
| 平衡时H2的物质的量 | n1 | n2 | n3 |
| 反应物的转化率 | α1 | α2 | α3 |
下列说法正确的是 ( )
A.v1=v2 B.K1<K3 C.n1>n2 D.α1+α2>1
2NO2(g)的反应历程分两步:
N2O2(g) (快速平衡)
_________。
2NO(g) ΔH=+180.0 kJ·mol-1,CO的燃烧热ΔH=-283.5 kJ·mol-1,某脱硝反应的平衡常数表达式为
,则该反应的热化学方程式为_________________________。
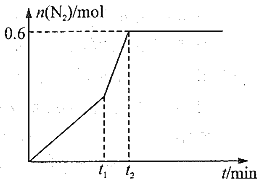
N2(g)+2CO2(g),60 min后,体系达到平衡状态,此时气体的压强变为原来的1.3倍,请回答下列问题。