-
已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法正确的是
Y
X
Z
A.Y是非金属性最强的元素
B.Z是金属元素
C.Y的原子序数为a-7
D.X的气态氢化物化学式为H2X
难度: 中等查看答案及解析
-
2-氯丁烷常用于有机合成等,有关2-氯丁烷的叙述正确的是( )
A.它的同分异构体除本身外还有4种
B.与硝酸银溶液混合产生不溶于稀硝酸的白色沉淀
C.微溶于水,可混溶于乙醇、乙醚、氯仿等多数有机溶剂
D.与氢氧化钠、乙醇在加热条件下的消去反应有机产物只有一种
难度: 中等查看答案及解析
-
工业上制取大量的乙烯和丙烯常采用
A.裂解 B.减压分馏 C.催化裂化 D.常压分馏
难度: 简单查看答案及解析
-
C原子说法正确的是( )
A.质子数与中子数相等 B.电子数与质子数相等
C.中子数和电子数相等 D.质量数与质子数相等
难度: 中等查看答案及解析
-
下列表示氮原子结构的化学用语中,对核外电子运动状态描述正确且能据此确定电子能级的是( )
A.
B.
C.1s22s22p3 D.
难度: 中等查看答案及解析
-
下列有关化学基本概念的判断依据正确的是
A.弱电解质:溶液的导电能力弱 B.共价化合物:含有共价键
C.离子化合物:含有离子键 D.金属晶体:能够导电
难度: 简单查看答案及解析
-
常温常压下:S (s)+O2 (g)→SO2 (g)+297.16kJ,下列说法正确的是
A. 反应物的总能量低于产物的总能量
B. S(g)+O2(g)→SO2(g)+Q Q>297.16kJ
C. 反应中生成22.4 L SO2 (g),转移电子4mol
D. 反应中生成1 L SO2 (g),放出热量297.16kJ
难度: 中等查看答案及解析
-
常温下,在等体积①pH=0的硫酸 ②0.1mol·L-1NaOH溶液③pH =10的纯碱溶液水电离程度的大小顺序是( )
A.①>②>③ B.②>①>③ C.③>①>② D.③>②>①
难度: 中等查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于 SO2 转化为 SO3
C.蒸干 AlCl3 溶液无法得到无水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率
难度: 中等查看答案及解析
-
下列物质中按照纯净物,混合物,电解质和非电解质的顺序排列的是
A.盐酸,水煤气,醋酸,干冰 B.冰醋酸,盐酸,硫酸钠,乙醇
C.苛性钠,石灰石,铁,硫酸钡 D.胆矾,漂白粉,氯化钾,氯气
难度: 简单查看答案及解析
-
根据有机物的命名原则,下列命名正确的是( )
A.CH2Br- CH2Br 二溴乙烷 B.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷
C.CH3OOCCH3 甲酸乙酯 D.(CH3)3CCH(OH)CH3 3,3-二甲基-2-丁醇
难度: 中等查看答案及解析
-
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+要使溶液中
值增大,可以采取的措施是( )
A.加少量烧碱溶液 B.降低温度
C.加少量冰醋酸 D.加水
难度: 中等查看答案及解析
-
工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)( )
A.溴苯(溴):加NaOH溶液,分液
B.乙烷(乙烯):通入溴水,洗气
C.乙酸(水):加新制生石灰,蒸馏
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,分液
难度: 中等查看答案及解析
-
若阿伏伽德罗常数NA=
,以下关于m的说法正确的是( )
A.表示12C的实际质量 B.表示12C的质量数
C.表示12C的相对原子质量 D.表示碳元素的相对原子质量
难度: 中等查看答案及解析
-
氮氧化铝(AlON)是一种空间网状结构,硬度大熔点高的透明材料,描述正确的是
A.含有离子键 B.属于原子晶体
C.既有离子键又有共价键 D.属于离子晶体
难度: 简单查看答案及解析
-
某有机物结构如图所示,有关该物质的叙述正确的是
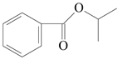
A.易溶于水
B.苯环上的一氯代物有3种
C.最多能与氢气以物质的量之比1∶4加成
D.碱性水解的产物中没有醇
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.氨气溶于醋酸溶液:NH3+H+ = NH4+
B.将硫化氢气体通入足量氢氧化钠溶液中:H2S+2OH- = S2- +2H2O
C.向氯化亚铁溶液中加入溴水:Fe2++ Br2 = Fe3++ 2Br-
D.AlCl3溶液中加入过量氨水 Al3++4OH- =AlO2-+2H2O
难度: 简单查看答案及解析
-
在体积可变的400 ℃密闭容器中,一定量的SO2和O2在催化剂作用下发生反应:2SO2(g)+O2(g)
2SO3(g)+QkJ,下列叙述错误的是( )
A.增大压强,正反应速率一直增大至不变,平衡正移
B.降低温度,正反应速率比逆反应速率减小的程度小
C.若将三氧化硫分离出,则平衡正向移动,平衡常数K值不变
D.若气体的物质的量减少0.5mol时达到平衡,则该条件下反应放出0.5QkJ的热量
难度: 中等查看答案及解析
-
下列有关化学键与晶体结构说法正确的是
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
难度: 中等查看答案及解析

 制备
制备