-
下列对价电子构型为2s22p5的元素描述正确的是( )
A.原子半径最小 B.原子序数为7 C.第一电离能最大 D.电负性最大
-
下列分子中的中心原子杂化轨道的类型相同的是( )
A.BeCl2与BF3 B.CO2与SO2
C.CCl4与NH3 D.C2H2和C2H4
-
某主族元素的离子X2+外围电子层排布为6s2,当把X的最高价氧化物溶于浓盐酸时,有黄绿色气体产生,则下列说法不正确的是( )
A.X2+具有还原性 B.X的最高价氧化物具有强氧化性
C.该元素是第ⅥA族元素 D.X的+2价化合物比+4价化合物稳定
-
下列分子中,所有原子都满足最外层为8电子结构的是
A.BF3 B.NCl3 C.PCl5 D.CHCl3
-
加拿大阿尔贡天文台在星际空间发现了HC9N链状分子,其结构为:HC≡C—C≡C—C≡C—C≡C—C≡N,这是人类迄今发现的最重星际有机分子,有关该分子的说法不正确的是( )
A.该物质不属于烃 B.该分子中含有9个σ键和10个π键
C.该分子在一定条件下可发生加成反应 D.该分子碳、氮原子均满足最外层八电子结构
-
下列有关杂化轨道的说法不正确的是( )
A.原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道
B.轨道数目杂化前后可以相等,也可以不等
C.杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理
D.杂化轨道可分为等性杂化轨道和不等性杂化轨道
-
下列关于σ键和π键的理解不正确的是( )
A.σ键一般能单独形成,而π键一般不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.碳碳双键中一定有一个σ键,一个π键,碳碳三键中一定有一个σ键,二个π键
D.CH3-CH3、CH2=CH2、CH≡CH中σ键键能相等,π键键能也相等
-
碘元素有多种价态,可以形成多种含氧阴离子IxOyn—。由2个IO62—正八面体共用一个面形成的IxOyn- 的化学式为( )
A.I2O94- B.I2O106- C.I2O118- D.I2O1210-
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物时,X可以显负价,Y显正价
B.第一电离能可能Y大于X
C.X的最高价含氧酸的酸性弱于Y的最高价含氧酸的酸性
D.气态氢化物的稳定性:HmY小于HnX
-
通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半满”、“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实能作为这个规则证据的是
A.元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
B.26Fe2+容易失电子转变成26Fe3+,表现出较强的还原性
C.基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
D.某种激发态碳(C)原子排布式为1s22s12p3而不是1s22s22p2
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期。已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中正确的是( )
A.由A、C、D三种元素组成的化合物一定是共价化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.元素的非金属性由强到弱的顺序是:D>C>F>B
-
下列说法中正确的是( )
A.某元素由化合态转变成游离态,该元素一定被还原
B.失电子难的原子获得电子的能力一定强
C.分子中共价键键长越短,键能越大,该分子一定越稳定
D.第一电离能越小的金属,其金属性一定越强
-
X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是( )
A.② B.②④ C.②⑤⑥ D.①②③④
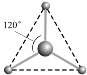 __________________;
__________________;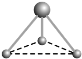 __________________。
__________________。