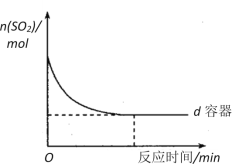
-
下列有关科学家及其创建理论的描述中,错误的是
A.拉瓦锡阐明了质量守恒定律 B.道尔顿创立分子学说
C.门捷列夫发现了元素周期律 D.勒沙特列发现化学平衡移动原理
难度: 简单查看答案及解析
-
对下列化学用语的理解正确的是 ( )
A.原子结构示意图
可以表示12C,也可以表示14C
B.比例模型
 可以表示二氧化碳分子,也可以表示水分子
可以表示二氧化碳分子,也可以表示水分子C.电子式
可以表示羟基,也可以表示氢氧根离子
D.分子式C2H4O2可以表示乙酸,也可以表示乙二醇
难度: 简单查看答案及解析
-
下列有关化学基本概念的判断正确的是( )
A.含有极性键的分子一定是极性分子 B.含有共价键的化合物一定是共价化合物
C.含有离子键的化合物一定是离子化合物 D.组成上相差n个CH2的分子一定是同系物
难度: 中等查看答案及解析
-
天然橡胶与溴接触,橡胶被破坏,主要是因为发生了
A.加成反应 B.取代反应 C.氧化反应 D.聚合反应
难度: 简单查看答案及解析
-
某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏,则该物质固态时属于
A.原子晶体 B.离子晶体 C.分子晶体 D.金属晶体
难度: 简单查看答案及解析
-
SiF4与SiCl4分子都是正四面体结构。下列判断正确的是( )
A.键长:Si-F>Si-Cl B.键能:Si-F>Si-Cl
C.沸点:SiF4>SiCl4 D.共用电子对偏移程度:Si-Cl>Si-F
难度: 中等查看答案及解析
-
下列试剂不能用来鉴别SO2和H2S的是
A.新制氯水 B.品红溶液 C.氢氧化钠溶液 D.氢硫酸
难度: 中等查看答案及解析
-
下列物质酸性最弱的是
A.CH3COOH B.CH3CH2OH C.H2CO3 D.H2O
难度: 简单查看答案及解析
-
可逆反应X(g) + Y
Z(g)中,其中Z是有色气体,当达到平衡时,下列叙述正确的是
A.增大压强,平衡体系颜色加深,说明Y必是气体
B.增大压强,当c(X)= c(Z) 时,则再次达到平衡
C.若Y是气体,增大X的浓度会使Y的转化率增大,化学平衡常数也增大
D.升温,Z的质量分数减小,说明正反应是放热反应
难度: 中等查看答案及解析
-
下列反应中,水作还原剂的反应是
A.CaO + H2O → Ca(OH)2 B.2Na + 2H2O → 2NaOH + H2↑
C.2F2 + 2H2O → 4HF + O2 D.2Na2O2 + 2H2O → 2NaOH + O2↑
难度: 中等查看答案及解析
-
反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是
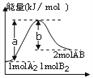
A.该反应是放热反应
B.加入催化剂,(b-a)的差值减小
C.每生成2molAB分子吸收bkJ热量
D.若反应生成AB为液态,吸收的热量小于(a-b)kJ
难度: 中等查看答案及解析
-
下列化工生产中未涉及勒沙特列原理的是
A.侯氏制碱法 B.合成氨 C.氯碱工业 D.工业制硫酸
难度: 中等查看答案及解析
-
下列曲线表示F、Cl、Br元素及所形成物质的某种性质随核电荷数的变化趋势,正确的是
A.
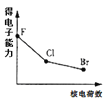 B.
B.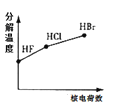 C.
C.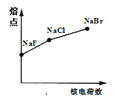 D.
D.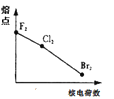
难度: 中等查看答案及解析
-
将浓度和体积均相同的一元酸HA与一元碱BOH混合,所得溶液呈酸性。下列判断正确的是
A.HA一定不是弱酸 B.BOH一定不是强碱
C.HA一定是强酸 D.BOH一定是强碱
难度: 中等查看答案及解析
-
下列烃与氯气反应,只生成一种一氯代物的是
A.2﹣甲基丙烷 B.异戊烷 C.间三甲苯 D.2,2﹣二甲基丙烷
难度: 简单查看答案及解析
-
用如图所示装置电解氯化铜溶液。下列判断正确的是

A.Y电极为正极
B.X电极质量增加
C.Y电极表面有氯气生成
D.X电极表面发生氧化反应
难度: 简单查看答案及解析
-
甲与乙在溶液中的转化关系如下图所示(反应条件省略),甲不可能是
A.NH3 B.AlO2- C.CO32- D.CH3COO-
难度: 简单查看答案及解析
-
下表是25℃时有关弱酸的电离平衡常数,下列叙述正确的是
HIO
HClO
H2CO3
K=2.3×l0-11
K=2.95×l0-8
K1=4.4×l0-7
K2=4.7×l0-11
A.同温、同浓度的NaIO、NaClO、NaHCO3和Na2CO3溶液中,碱性最强的是Na2CO3
B.向NaClO溶液中通入少量CO2,离子反应为:2ClO-+CO2+H2O→2HClO+ CO32-
C.向NaIO溶液中通入少量CO2,离子反应为:2IO-+CO2+H2O→2HIO+ CO32-
D.向NaHCO3溶液中加入少量HClO,离子反应为:HCO3-+ HClO→CO2↑+H2O+ ClO-
难度: 中等查看答案及解析
-
下列各组物质充分反应后,滴入KSCN溶液一定显红色的是( )
A.FeO加入稀硝酸中 B.FeCl3、CuCl2溶液中加入过量的铁粉
C.生了锈的铁块加入稀硫酸中 D.Fe加入稀硝酸中
难度: 简单查看答案及解析
-
某无色溶液可能含有H+、Na+、Al3+、Br- 、HCO3- 、SO42- 和NO3- ,且各离子的物质的量浓度相等。分别取样,①测得该溶液的pH=1;②滴加适量氯水,溶液变为橙色;③滴加过量Ba(OH)2溶液,有沉淀生成。由此可知原溶液中
A.一定含有NO3- B.可能含有Na+
C.可能不含Al3+ D.含有3种离子
难度: 中等查看答案及解析