-
SO2的催化氧化是工业制取硫酸的关键步骤之一:2SO2 + O2 2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2mol SO2和1mol O2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2mol SO2和1mol O2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
| 容器温度 物质的量(mol) | a容器 400℃ | b容器 425℃ | c容器 450℃ | d容器 475℃ | e容器 500℃ |
| O2 | x | 0.6 | 0.3 | 0.5 | 0.7 |
| SO3 | y | 0.8 | 1.4 | 1.0 | 0.6 |
(1)5min时测得a容器中混合气体的物质的量减少了0.2mol,计算5min内SO3的平均反应速率____________。
(2)反应进行到5min时,b容器中的反应是否达到平衡状态?_______(填“是”或“否”),理由是:_____________________________________________________________________________。
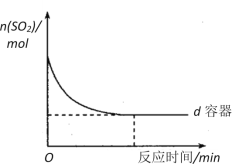
(3)在图中画出e容器中SO2物质的量随时间的变化曲线_______________________。
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:___________________。
(5)已知NaHSO3溶液呈酸性,溶液中c(H2SO3)_______ c(SO32—)(选填<、>或=);NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_______________
-
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
-
工业制硫酸的关键步骤之一为SO2的接触氧化:
 2SO2(g)+O2(g) 2SO3(g);△H= —196.6kJ/mol
2SO2(g)+O2(g) 2SO3(g);△H= —196.6kJ/mol
现在一容积为2L的密闭容器中充入2 molSO2、l molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 mm时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是 ( )
A.S02的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应谏率为u.30 mol·L—1,min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态与上述平衡完全相同
-
SO2的催化氧化:  ,是工业制取硫酸的关键步骤之一。在容积都为2L的
,是工业制取硫酸的关键步骤之一。在容积都为2L的 、
、 、
、 、
、 、
、 五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
| 容器温度 物质的量(mol) |  容器 容器
400℃ |  容器 容器
425℃ |  容器 容器
450℃ |  容器 容器
475℃ |  容器 容器
500℃ |
| O2 | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
| SO3 | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |
(1)计算5min内 容器中SO2的平均反应速率___________________________。
容器中SO2的平均反应速率___________________________。
(2)反应进行到5min时,  容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
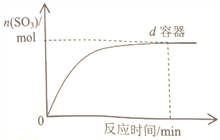
(3)在右图中画出 容器中SO3物质的量随时间的变化曲线。____________
容器中SO3物质的量随时间的变化曲线。____________
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:______________________。
(5)Na2SO3和NaHSO3混合溶液的pH随Na2SO3和NaHSO3比例的不同而不同,数据如下:
| 序号 | ① | ② | ③ |
| 
| 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
表中第________组(填写序号)数据,可判断NaHSO3溶液显_______性(填“酸”或“碱”)。
(6)NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_________________________________________________________。
-
(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:
SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的
是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为________;
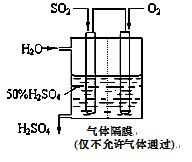
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________________。
-
(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:
SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的
是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为________;
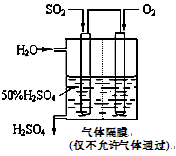
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________________。
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: §SO2(g) +1/2O2(g) SO3(g)+ 98 kJ
SO3(g)+ 98 kJ
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)
________v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为20 L的密闭容器中充入0.4 mol SO2和0.2 mol O2,达到平衡后体积变为16 L,则平衡后SO2转化的百分率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入0.2 mol O2
B.保持温度和容器内压强不变,充入0.4 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以下图所示装置,用电化学原理生产硫酸, 为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____________。

-
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤.
(1)某温度下,SO2(g)+ O2(g)⇌SO3(g);△H=-98kJ•mol-1.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=______.
O2(g)⇌SO3(g);△H=-98kJ•mol-1.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=______.
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)⇌2SO3(g),达平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是______(填字母).
A.保持温度和容器不变,充入2molSO3
B.保持温度和容器体积不变,充入2molN2
C.保持温度和容器内压强不变,充入1molSO3
D.移动活塞压缩气体
E.升高温度
(3)下列关于2SO2(g)+O2(g)⇌2SO3(g)反应的图象中,不正确的是______.
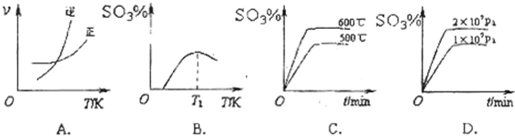
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境.于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸.
①阳极的电极反应为______.
②若电解液为2L 0.025mol•L-1的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为______,此溶液的pH=______ (忽略溶液体积变化).
③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价______(写出一点即可).
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+ O2(g)
O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________ v(逆)(填“<”、“>”或“=”)。
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) ________ v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)若以如图所示装置,用电化学原理生产硫酸, 写出通入O2电极的电极反应式为________。
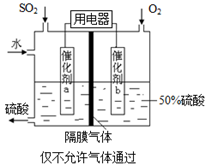
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为_____。
-
硫及其化合物用途广泛,研究硫及其化合物性质和用途意义重大。
⑴利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+1/2O2(g) SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3。
①该温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _________ v (逆)(填“<”、“>”或“=”)。
(逆)(填“<”、“>”或“=”)。
②该温度下,向一体积为2 L的恒容密闭容器中充入2.0 mol SO2和1.0 molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为_______________。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__________(填字母)。
A.保持 温度和容器体积不变,充入1.0 mol O2
温度和容器体积不变,充入1.0 mol O2
B.升高温度
C.保持温度和容器体积不变,充入1.0  mol SO3
mol SO3
D.增大容器体积
⑵室温下,Li /FeS2二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是___________________。
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产生物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等,请写出化学反应方程式:第一次放电:__________________;第二次放电:________________。
⑶制取高纯度黄铁矿的另一种方法是:以LiCl—KCl低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解,写出阳极方程式______________。
2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2mol SO2和1mol O2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:






