-
下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是




A.4.03米大口径碳化硅反射镜
B.2022年冬奥会聚氨酯速滑服
C.能屏蔽电磁波的碳包覆银纳米线
D.“玉兔二号”钛合金筛网轮
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法错误的是 ( )
A.In是第五周期第ⅢB族元素 B.
In的中子数与电子数的差值为17
C.原子半径:In>Al D.碱性:In(OH)3<RbOH
难度: 简单查看答案及解析
-
用示意图或图示的方法能够直观形象地展示化学知识。以下图示正确的是:( )
A.溴原子结构示意图
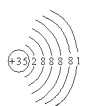
B.2s电子云模型示意图
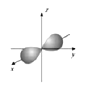
C.石墨晶体结构示意图
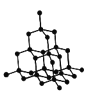
D.放热反应过程中能量变化示意图
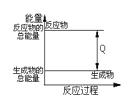
难度: 中等查看答案及解析
-
芬太尼(结构式如图)是一种强效的类阿片止痛剂,起效迅速而作用时间极短。当它与药物联合使用时,通常用作疼痛药物或麻醉剂。下列说法正确的是
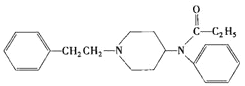
A. 它的分子式是C22H27N2O B. 它和苯是同系物
C. 它属于烃的衍生物 D. 药物可以过量使用
难度: 中等查看答案及解析
-
下列涉及化学学科观点的有关说法正确的是
A.微粒观:二氧化硫是由硫原子和氧原子构成的
B.转化观:升高温度可以将不饱和硝酸钾溶液转变为饱和
C.守恒观:1g镁与1g稀硫酸充分反应后所得的溶液质量为2g
D.结构观:金刚石和石墨由于结构中碳原子的排列方式不同,性质存在着较大的差异
难度: 简单查看答案及解析
-
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是( )
A.用装置
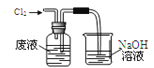 氧化废液中的溴化氢
氧化废液中的溴化氢B.用装置
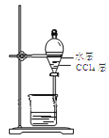 分离油层和水层
分离油层和水层C.用装置
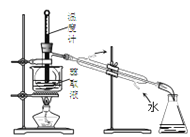 分离四氯化碳和液溴
分离四氯化碳和液溴D.用仪器
 密封存放单质溴
密封存放单质溴难度: 中等查看答案及解析
-
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是 ( )
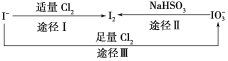
A.用KI淀粉试纸和食醋可以检验加碘盐中是否含有碘
B.足量Cl2能使湿润的KI淀粉试纸变白的原因可能是:5Cl2+I2+6H2O→2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2< IO3-< I2
D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
难度: 中等查看答案及解析
-
下列有关电化学的图示,完全正确的是 ( )
A.Cu-Zn原电池

B.粗铜的精炼

C.铁片镀锌

D.验证气体产物

难度: 中等查看答案及解析
-
常温下,一定能大量共存的离子组是 ( )
A.澄清透明溶液中:K+、Cu2+、Na+、Cl-
B.0.5 mol/L NaAlO2 溶液中:K+、Na+、SO42-、Fe3+
C.
=0.1 mol/L的溶液中:Na+、K+、HCO3-、NO3-
D.使甲基橙呈红色的溶液中:I-、Cl-、NO3-、Na+
难度: 中等查看答案及解析
-
如图是利用试纸、铅笔芯设计的微型实验。以铅笔芯为电极,分别接触表面皿上的部分交叠的两张试纸,接通电源,观察实验现象。下列说法错误的是( )
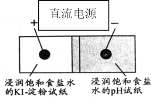
A.pH试纸变蓝
B.KI-淀粉试纸变蓝
C.此装置不属于原电池
D.电子通过pH试纸到达KI-淀粉试纸
难度: 中等查看答案及解析
-
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如下图所示,下列判断正确的是
A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C.a、b、c三点溶液水的电离程度a>b>c
D.与等体积b、c处溶液反应,消耗等量的NaOH
难度: 中等查看答案及解析
-
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是

A.元素Y与元素Z的最高正化合价之和的数值等于9
B.原子半径的大小顺序为:W>Z>Y
C.离子半径的大小顺序为:W2->Y2->Z3+
D.W的气态氢化物的热稳定性和还原性均比Q强
难度: 中等查看答案及解析
-
25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)=c(OH-) + c(A-)
B.Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.将醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl—)=c(CH3COOH)
D.pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-)
难度: 困难查看答案及解析
-
C60可用作储存氢气的材料,结构如右图所示。继C60后,科学家又合成了Si60、N60,三种物质结构相似。下列有关说法正确的是

A.C60、Si60、N60都属于原子晶体
B.C60、Si60、N60分子内共用电子对数目相同
C.由于
键能小于
,故N60的稳定性弱于N2
D.由于
键长小于
键,所以C60熔、沸点低于Si60
难度: 中等查看答案及解析
-
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A.与NaOH反应的氯气为0.25 mol
B.n(Na+):n(Cl-) 可能为7:3
C.若反应中转移的电子为n mol,则0.15n0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
难度: 中等查看答案及解析
-
25℃时,将浓度和体积分别为c1、V1的一元强碱ROH溶液和c2、V2的一元弱酸HA溶液相混合,下列关于该混合溶液的叙述正确的是 ( )
A.若pH>7时,则一定是c1V1 =c2V2
B.只有当pH<7时,才能满足c(R+)+c(H+)=c(A-)+c(OH-)
C.当pH=7时,若V1 = V2,则一定是c1>c2
D.若V1=V2、 c1=c2,则c(A-)+c(HA)=c(R+)
难度: 中等查看答案及解析
-
Na2CO3溶液中存在水解平衡:CO32-+H2O
HCO3-+OH-。下列说法错误的是( )
A.加水稀释,溶液中所有离子的浓度都减小 B.通入CO2,溶液pH减小
C.加入NaOH固体,
减小 D.升高温度,平衡常数增大
难度: 中等查看答案及解析
-
化学反应N2+3H2→2NH3的能量变化如图所示,该反应的热化学方程式是 ( )

A.
N2(g)+
H2(g)→ NH3(l) △H=-46kJ/mol
B.
N2(g)+
H2(g)→ NH3(g) △H=-454kJ/mol
C.N2(g)+3H2(g)→2NH3(g) △H=-92kJ/mol
D.N2(g)+3H2(g)→2NH3(1) △H= +431.3kJ/mol
难度: 中等查看答案及解析
-
相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
容器编号
起始时各物质的物质的量 / mol
达到平衡时体系能量的变化/kJ
SO2
O2
SO3
甲
2
1
0
放出热量:Q1
乙
1.8
0.9
0.2
放出热量:Q2
下列判断中正确的是
A.两容器中反应的平衡常数不相等
B.达到平衡时SO2的体积分数:甲<乙
C.197>Q1>Q2
D.生成1molSO3(l)时放出的热量等于98.5kJ
难度: 中等查看答案及解析
-
常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
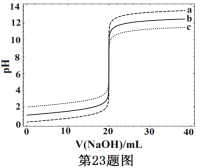
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
难度: 中等查看答案及解析


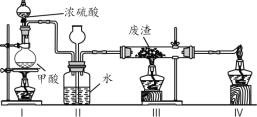
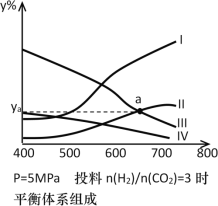
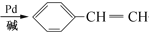 -M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: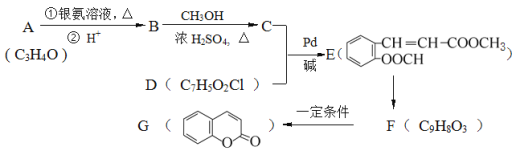
 (R、R′为烃基)。试写出以苯和丙烯(CH2=CH-CH3)为原料,合成
(R、R′为烃基)。试写出以苯和丙烯(CH2=CH-CH3)为原料,合成 的路线流程图(无机试剂任选)。_______
的路线流程图(无机试剂任选)。_______