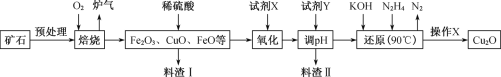
-
下列化学用语表示正确的是
A.氯化氢的电子式:
B.钠原子的结构示意图:
C.乙烯的结构简式:CH2CH2 D.碳酸氢钠的电离方程式:NaHCO3= Na+ + H+ + CO32-
难度: 简单查看答案及解析
-
萤石(Fluorite),又称氟石,是一种矿物,其主要成分是氟化钙(CaF2),CaF2属于
A.单质 B.盐 C.碱 D.酸
难度: 简单查看答案及解析
-
化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是( )
A.苛性钠——NaOH B.绿矾——CuSO4·5H2O
C.醋酸——C2H5OH D.熟石灰——CaSO4
难度: 简单查看答案及解析
-
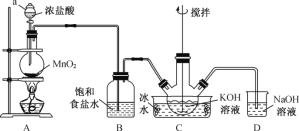
下列实验室制取、干燥、收集NH3并进行尾气处理的装置和原理能达到实验目的的是
A.
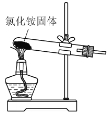 制取NH3 B.
制取NH3 B.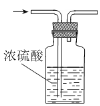 干燥NH3
干燥NH3C.
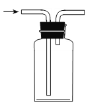 收集NH3 D.
收集NH3 D. 尾气处理
尾气处理难度: 中等查看答案及解析
-
在含有大量Ag+、H+、NO3-的溶液中,还可能大量共存的离子是
A.Cl- B.Fe2+ C.K+ D.HCO3-
难度: 简单查看答案及解析
-
下列物质含有共价键的是( )
A.NaCl B.MgCl2 C.H2S D.K2O
难度: 简单查看答案及解析
-
下列物质属于天然高分子化合物的是
A.蚕丝 B.聚氯乙烯 C.麦芽糖 D.油脂
难度: 简单查看答案及解析
-
下列有关物质的用途说法错误的是
A.液氨可用作工业上的制冷剂 B.明矾可用于水的杀菌消毒
C.碳酸氢钠可用于焙制糕点 D.硫酸钡可做肠胃检查内服药
难度: 简单查看答案及解析
-
下列每组中的两种互为同素异形体的是( )
A.金刚石与石墨 B.CH4与CH3CH3
C.葡萄糖与蔗糖 D.12C与13C
难度: 简单查看答案及解析
-
下列关于苯的说法正确的是
A.常温下苯是无色无味的液体 B.苯的密度比水小
C.苯存在单、双键交替结构 D.苯不能发生取代反应
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.H2SO4溶液与氢氧化钠反应:OH-+H+=H2O
B.铝与NaOH溶液反应:Al+2OH-=
+H2↑
C.AlCl3溶液与氨水反应:AlCl3+3OH-=Al(OH)3↓+3Cl-
D.Cl2与氢氧化钠溶液反应:Cl2+2OH-=2ClO-+H2O
难度: 中等查看答案及解析
-
某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是 ( )
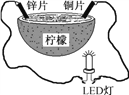
A. 铜片作负极
B. 锌片发生还原反应
C. 将电能转化为化学能
D. 电子由锌片经导线流向铜片
难度: 简单查看答案及解析
-
下列有机反应属于加成反应的是( )
A.CH4 + Cl2
CH3Cl + HCl
B.2CH3CH3+5O2
2CO2+6H2O
C.
+3H2
D.2CH3CH2OH+2Na
2CH3CH2ONa+H2
难度: 简单查看答案及解析
-
下列实验方案不能达到目的是
A.用饱和NaHCO3溶液除去CO2中的HCl
B.用加热的方法除去CaO固体中的少量CaCO3
C.通入氯气可除去FeCl3溶液中含有的FeCl2
D.用分液漏斗从食醋中分离出乙酸
难度: 简单查看答案及解析
-
X、Y、Z、Q、W是原子序数依次增大的短周期主族元素,X的原子半径最小,Y的原子最外层电子数是其电子层数的2倍,Z是短周期金属性最强的元素,元素Q的单质可被用作输电的导线,W的单质为黄绿色有毒气体。下列说法正确的是( )
A.最高价氧化物所对应水化物的酸性:Y>W
B.原子半径:W>Q>Z
C.化合物XW与ZW含有相同类型的化学键
D.元素Z、Q的最高价氧化物对应水化物能发生反应
难度: 中等查看答案及解析
-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明氯水的氧化性强于I2
B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明Cl2有漂白性
C.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl﹣
D.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
难度: 中等查看答案及解析
-
新能源的开发利用是人类社会可持续发展的重要课题。下列属于新能源的是
A. 煤炭 B. 石油 C. 天然气 D. 氢气
难度: 简单查看答案及解析
-
L/mol是哪个物理量的单位
A.摩尔质量 B.物质的量 C.气体摩尔体积 D.物质的量浓度
难度: 简单查看答案及解析
-
在生产生活中,下列不属于化学变化的是
A.用铁矿石冶炼铁 B.煤的液化
C.用石油分馏得汽油 D.氯碱工业制氢氧化钠
难度: 简单查看答案及解析
-
下列厨房中常见物质,溶于水之后形成的溶液能产生丁达尔效应的是( )
A.纯碱 B.食盐 C.料酒 D.鸡蛋清
难度: 简单查看答案及解析
-
氢氧化钾溶液在火焰上灼烧时,火焰呈现的颜色为 ( )
A.洋红色 B.紫色 C.绿色 D.黄色
难度: 简单查看答案及解析
-
Ts是一种人工合成的超重化学元素,元素名称为
,中子数为( )
A.117 B.293 C.176 D.410
难度: 简单查看答案及解析