-
下列污染现象主要与NO2有关的是 ( )
A.臭氧空洞 B.水体富营养化 C.光化学烟雾 D.温室效应
难度: 简单查看答案及解析
-
下列有关酸雨的说法不正确的是
A.二氧化碳的排放是形成酸雨的主要原因
B.大量燃烧含硫的化石燃料是形成酸雨的主要原因
C.酸雨的pH小于5.6
D.减少酸雨的产生可采取的措施是对燃料进行脱硫
难度: 简单查看答案及解析
-
下列化学物质在实验室存放,方法正确的是
A.浓硝酸保存在无色试剂瓶中
B.浓硫酸保存在带玻璃塞的广口瓶中
C.少量金属钠保存在煤油中
D.漂白粉可露置在空气中保存
难度: 中等查看答案及解析
-
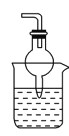
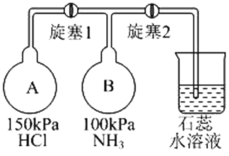
喷泉是一种常见的自然现象,如下图是化学教材中常用的喷泉实验装置,在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体。下列气体和液体的组合中不可能形成喷泉的是
A. HCl和H2O B. CO2和NaOH溶液 C. NH3和H2O D. O2和H2O
难度: 中等查看答案及解析
-
下列溶液中能够区别 SO2 和 CO2 气体的是
①澄清石灰水 ②H2S 溶液 ③KMnO4 酸性溶液 ④氯水 ⑤品红溶液
A.①②③ B.②③④ C.除①以外 D.全部
难度: 中等查看答案及解析
-
下列说法中正确的是
①有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向低处跑
②钠在空气中加热,钠块先熔成光亮的银白色小球后燃烧
③Fe2O3可以做油漆的颜料
④用明矾做净水剂除去水中的悬浮物
⑤NaOH溶于水呈碱性,故可用于治疗胃酸过多
A.①③④ B.②③④ C.①②⑤ D.②③⑤
难度: 简单查看答案及解析
-
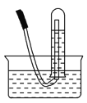
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管被水充满,原来试管中盛装的气体是
A.肯定是NO2气体
B.肯定是O2与NO2的混和气体
C.肯定是NO气体
D.可能是NO与NO2的混和气体
难度: 中等查看答案及解析
-
下列关于自然界中氮循环(如图)的说法不正确的是:
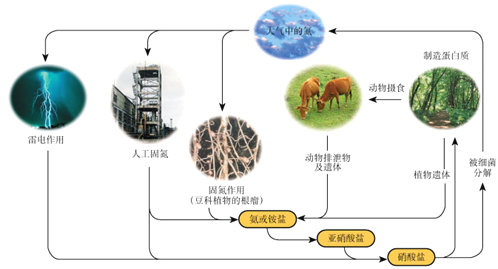
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参与了氮循环
难度: 中等查看答案及解析
-
下列反应中,既属于离子反应又属于氧化还原反应的是
A.SO2+Cl2+2H2O=H2SO4+2HCl B.SO2+Ca(OH)2=CaSO3↓+H2O
C.Fe+S
FeS D.2SO2+O2
2SO3
难度: 中等查看答案及解析
-
实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl
NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是
A.NaNO2是氧化剂,NH4Cl是还原剂
B.N2既是氧化产物,又是还原产物
C.氧化剂和还原剂的物质的量之比是1︰1
D.每生成1 mol N2时,转移电子的物质的量为6 mol
难度: 中等查看答案及解析
-
下列有关NaHCO3与Na2CO3的性质说法中,正确的是
A.相同温度时,Na2CO3的溶解度小于NaHCO3的溶解度
B.除去碳酸氢钠固体中混有的少量碳酸钠可以采用加热的方法
C.与同浓度稀盐酸反应,NaHCO3放出气泡的速率更快
D.将二者配成溶液,再分别滴加Ca(OH)2溶液,无白色沉淀生成的是NaHCO3
难度: 中等查看答案及解析
-
下列关于铁及其化合物的说法正确的是
A.铁与CuSO4溶液反应后滴加KSCN溶液,溶液变红
B.FeCl2既有氧化性又有还原性
C.除去FeCl2溶液中的少量氯化铁,可通入氯气
D.补铁保健品中,含有+3价的铁元素
难度: 中等查看答案及解析
-
一定条件下,将等体积的NO2和O2的混合气体置于试管并将该试管倒置于水槽中至液面不再上升时,剩余气体的体积约为原体积的( )
A. 1/4 B. 3/4 C. 1/8 D. 3/8
难度: 中等查看答案及解析
-
下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是
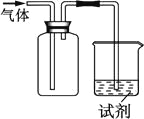
选项
气体
试剂
现象
结论
A
NO
紫色石蕊试液
溶液变红
NO与水反应生成硝酸
B
Cl2
KI淀粉溶液
溶液变蓝
Cl2有氧化性
C
SO2
酸性KMnO4溶液
溶液褪色
SO2有漂白性
D
NH3
酚酞试剂
溶液变红
NH3有碱性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
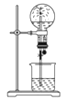
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
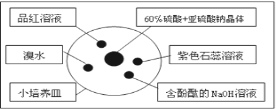
A. 紫色石蕊溶液先变红后褪色 B. 品红溶液褪色
C. 溴水橙色褪去 D. 含酚酞的NaOH溶液红色变浅
难度: 中等查看答案及解析
-
下列实验中,能达到实验目的的是
A.分离碘和酒精
B.除去Cl2中HCl
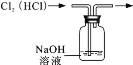
C.实验室制氨气
 D.排水法收集H2
D.排水法收集H2
难度: 中等查看答案及解析
-
NaNO2有像食盐一样的外观和咸味,它对人体的毒性表现为:可将正常的血红蛋白变为高铁血红蛋白(使血红蛋白中的铁元素由二价变为三价),失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。下列有关NaNO2毒性分析正确的是
A.因解毒剂美蓝具有氧化性 B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原 D.中毒时血红蛋白分子被还原
难度: 中等查看答案及解析
-
下列物质分类正确的是
A.CO2、CO均为酸性氧化物 B.氯水、氨水均为混合物
C.纯碱、火碱均为属于碱 D.牛奶、醋酸均为胶体
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法不正确的是
A.4.6克钠与水反应时失去的电子数目为0.2NA
B.常温常压下2克氢气所含原子数目为NA
C.在标准状况下,22.4LNH3所含的分子数目为NA
D.1 L0.5mol•L-1Na2SO4溶液中所含有的Na+离子数目为NA
难度: 简单查看答案及解析
-
下列关于氧化还原反应的原理分析,正确的是
A.失电子越多,该物质的还原性就越强
B.含有最高价元素的化合物一定具有强氧化性
C.氧化剂氧化其他物质时,本身被还原
D.某元素由化合态变成游离态一定被还原
难度: 简单查看答案及解析
-
有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
方案
操 作
判 断
A
分别加入澄清石灰水
产生沉淀者为Na2CO3
B
分别加入等浓度的稀盐酸
反应较剧烈者为Na2CO3
C
分别加入CaCl2溶液
产生沉淀者为Na2CO3
D
逐滴加入等浓度的盐酸
立即产生气泡者为Na2CO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知氧化性:Cl2>Fe3+>S,则下列反应不能发生的是
A.S+2Fe2+=2Fe3++S2- B.2Fe3++S2-=2Fe2++S↓
C.S2-+Cl2=S↓+2Cl- D.2Fe2++Cl2=2Fe3++2Cl-
难度: 中等查看答案及解析
-
根据SO2通入不同溶液中的实验现象,所得结论不正确的是
选项
溶液
现象
结论
A
含HCl、BaCl2的FeCl3溶液
产生白色沉淀
SO2有还原性
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
D
溴水
橙色褪去
SO2有还原性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.2mol•L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A.5.3g B.10.6g C.4.2g D.3.1g
难度: 中等查看答案及解析
-
将6.4 g Cu与400 mL 5 mol·L-1的足量HNO3溶液充分反应,还原产物为NO2和NO。如果反应结束后的溶液中含有H+a mol,则此时溶液中NO3-的物质的量为
A.0.5a mol B.(a+0.2) mol
C.2a mol D.(0.2-a) mol
难度: 中等查看答案及解析


 d.
d.  ②.
②. 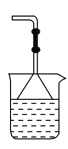 ③.
③.  ④.
④.