-
工业废水、废渣不经处理,会对环境造成很大的危害。利用化学原理可以对工厂排放的废水、废渣等进行有效检测、处理及应用。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下,Cr(Ⅲ)最终转化为CrOH(H2O)5SO4。
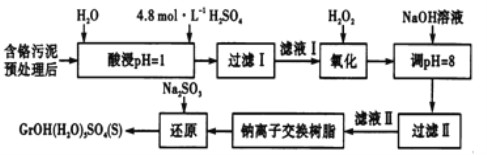
常温下,部分阳离子以氢氧化物形式沉淀时,溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ |
| 开始沉淀时的pH | 2.7 | — | — |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 |
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒、量筒和胶头滴管外,还需_______,配制时所需浓H2SO4的体积为_______mL(小数点后保留一位数字)。
(2)酸浸时,为了提高浸取率,除了适当增大酸的浓度外,还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(5)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______。
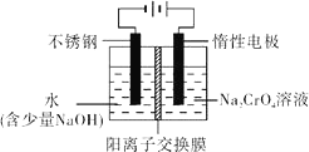
(6)工业上还可用电解法制备重铬酸钠,其装置示意图如图.阴极的电极反应式为____________, 阳极的电极反应式为____________。
-
黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
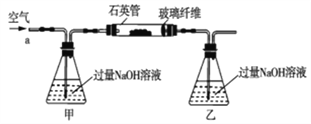
(实验一)测定硫元素的含量
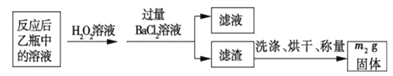
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方 程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出 表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00 mL稀释液,用0.100 mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
-
能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJ•mol-1、-b kJ•mol-1、-c kJ•mol-1;
②H2O (l) =H2O(g); △H=+dkJ•mol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJ•mol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g) CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
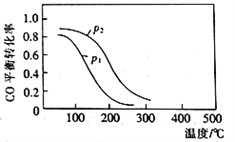
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 0〜3 min内用CH3OH表示的反应速率v(CH3OH)=________mol • L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
-
X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。

(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)

(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
-
有机花儿会务X( )是有机精细化工的重要中间体,实验室中以M(
)是有机精细化工的重要中间体,实验室中以M(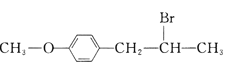 )为原料合成X的路线如下:
)为原料合成X的路线如下:
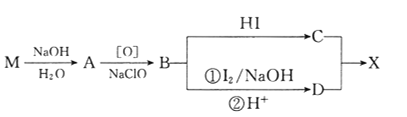
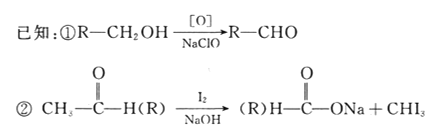
回答下列问题:
(1)B的核磁共振氢谱上有________组峰。
(2)D分子中含有的官能团有_________________________。(填名称)
(3)下列常见含钠试剂能与C反应的有______________。(填标号)
a.氯化钠 b.氢氧化钠 c.纯碱 d.碳酸氢钠
(4)由B转化为C的化学方程式为______________________________,该反应的反应类型是_______________________。
(5)E是D的同分异构体,在苯环的对位上各有一个取代基,能够发生银镜反应和水解反应,1molE与足量钠反应可生成0.5molH2,则E可能的结构有_____种。
(6)有机物F(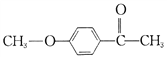 )也是一种重要的有机精细化工中间体,写出由
)也是一种重要的有机精细化工中间体,写出由 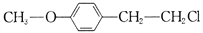 制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:
制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如: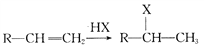 )_________________.
)_________________.

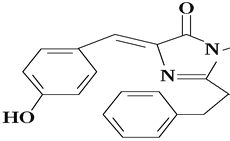








 )是有机精细化工的重要中间体,实验室中以M(
)是有机精细化工的重要中间体,实验室中以M( )为原料合成X的路线如下:
)为原料合成X的路线如下:

 )也是一种重要的有机精细化工中间体,写出由
)也是一种重要的有机精细化工中间体,写出由  制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:
制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如: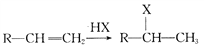 )_________________.
)_________________.