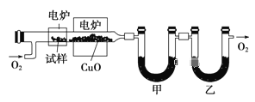
-
化学与生产、生活、社会密切相关,下列说法正确的是( )
A.少量的生石灰能作为鸡舍和猪栏的消毒剂
B.石油裂化和裂解制取乙烯、丙烯等化工原料不涉及化学变化
C.误食重金属盐引起的人体中毒,可以喝大量的食盐水解毒
D.常用危险化学品标签中的阿拉伯数字主要表示的是危险级别
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.Na2O2中的阴离子符号:O2-
B.Na和Cl形成离子键的过程:
C.次氯酸的结构式:H—Cl—O
D.比例模型
可表示CH4分子,也可表示CCl4分子
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A.31 g白磷(
)含有共价键的总数为1.5NA
B.常温下,22.4 mL H2O中所含氢氧键的数目约为2.49NA
C.8.7 g MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
D.常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:H++ SO42-+ Ba2++OH-= BaSO4↓+ H2O
B.向Na2S2O3溶液中滴加稀硫酸:S2O32- + 2H+ = SO2↑+ S↓+ H2O
C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: 3ClO-+2Fe(OH)3= 2FeO42-+3Cl-+H2O+4H+
D.向含有0.4mol FeBr2的溶液中通入0.4molCl2充分反应:4Fe2++2Br-+3C12=4Fe3++6C1-+ Br2
难度: 中等查看答案及解析
-
下列关于金属及其化合物的说法,正确的是( )
A.黑色金属是指铁、铬、锰以外的金属
B.用钠置换四氯化钛溶液中的钛,来制取钛
C.把饱和的FeCl3溶液滴入沸水中,继续煮沸至溶液变为红褐色,可制得Fe(OH)3胶体
D.用无水硫酸铜除去酒精中的水
难度: 简单查看答案及解析
-
有机化合物环丙叉环丙烷,由于其特殊的电子结构一直受到理论化学家的注意,如图是它的结构示意图。下列关于环丙叉环丙烷的有关说法中错误的是( )
A.环丙叉环丙烷的二氯取代物有4种 B.环丙叉环丙烷不是环丙烷的同系物
C.环丙叉环丙烷所有的原子均在同一平面内 D.环丙叉环丙烷与环己二烯互为同分异构体
难度: 中等查看答案及解析
-
下列关于有机化合物的叙述中错误的是
A.汽油、柴油、石蜡都是多种碳氢化合物的混合物
B.苯与铁粉、溴水混合可制备密度大于水的溴苯
C.利用酸性高锰酸钾溶液可除去CO2中混有的乙烯
D.只用溴水可鉴别苯、己烯和四氯化碳
难度: 简单查看答案及解析
-
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知转化过程中的反应为2CrO42-(aq)+2H+(aq)
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有
转化为Cr2O72-,下列说法不正确的是( )
A.溶液颜色保持不变,说明上述可逆反应达到平衡状态
B.若用FeSO4作还原剂,处理1L废水,至少需要1.65mol
C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
难度: 困难查看答案及解析
-
利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)
N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:

下列说法正确的是
A.组别①中0 ~20 min内,NO2降解速率为0.0125mol•L-1•min-1
B.由实验数据可知温度T1<T2
C.40min时,表格中M对应的数据为0.18
D.该反应只有在高温下才能自发进行
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大。W的最外层电子数是次外层的2倍,X、Y原子的最外层电子数之比为3:4,Z的单质常温下呈气态。下列说法正确的是( )
A. 原子半径:Z>Y>X>W
B. 含氧酸的酸性:Z>W>Y
C. 最高价氧化物的熔点:W>Y
D. Z分别与W、X形成的二元化合物中,化学键类型相同
难度: 简单查看答案及解析
-
由下列实验及现象不能推出相应结论的是
选项
实验
现象
结论
A
向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI
溶液变蓝色
氧化性:IO
>I2
B
向稀氨水和酚酞混合溶液中加入少量Ag2O,振荡
溶液由浅红色变为红色
Ag2O是强碱
C
向装有经过硫酸处理的CrO3(桔红色)的硅胶导管中吹入乙醇蒸气
固体逐渐由桔红色变为浅绿色(Cr3+)
乙醇具有还原性
D
向盛有少量水的烧杯中加入少量Mg2Si
产生白色沉淀,液面上有火苗
Mg2Si水解生成Mg(OH)2和SiH4
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某工厂采用如图装置处理化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为惰性电极。下列说法不正确的是( )
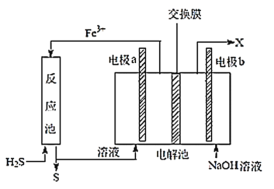
A.电极 a 为阳极
B.若交换膜为阳离子交换膜,b 电极区会产生红褐色沉淀
C.反应池中处理H2S的反应是H2S +2Fe3+ = 2Fe2+ +S↓+2H+
D.若交换膜为质子交换膜,则NaOH溶液的浓度逐渐变大,需要定期更换
难度: 中等查看答案及解析
-
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
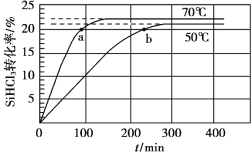
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
难度: 中等查看答案及解析
-
常温下,向浓度均为 0.1mol·L−1、体积均为100mL的两种一元酸HA、HB的溶液中,分别加入固体NaOH,溶液中的lg
随加入 NaOH 的物质的量的变化如图所示。下列说法正确的是

A.由水电离出的 c(H+)的顺序为:c﹥a﹥b
B.b 点时酸碱恰好完全中和
C.c 点溶液中:c(B−)﹥c(HB)
D.常温下电离常数:HA﹤HB
难度: 困难查看答案及解析


 _________________________
_________________________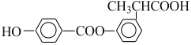 _________
_________