-
某实验小组研究KI和酸性KMnO4溶液的反应。
| 实验序号 | Ⅰ | Ⅱ |
| 实验操作 | 
| 
|
| 实验现象 | 紫色褪去,溶液变为棕黄色 | 紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
资料:i. MnO4— 在酸性条件下最终被还原为Mn2+。ii. 酸性条件下氧化性: KMnO4>KIO3>I2 。
(1)实验1中溶液呈棕黄色,推测生成了________。
(2)实验小组继续对实验II反应中初始阶段的产物成分进行探究:
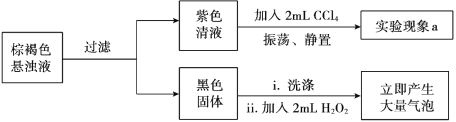
①经检验,实验II初始阶段I— 的氧化产物不是I2,则“实验现象a”为________。
②黑色固体是________。
③设计实验方案证明在“紫色清液”中存在IO3-:________。
④写出生成IO3-的离子方程式:________。
(3)探究实验II中棕褐色沉淀消失的原因。
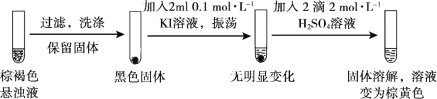
用离子方程式解释实验II中棕褐色沉淀消失的原因:________。
(4)实验反思:KI和酸性KMnO4溶液反应过程中,所得产物成分与________有关(写出两点即可)。
-
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
| KMnO4酸性溶液浓度(mol·L-1) | 溶液褪色所需时间(min) | |
| 第一次 | 第二次 | 第三次 |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
| | | | |
①用0.002 mol·L-1 KMnO4酸性溶液进行实验时,KMnO4的平均反应速率 (忽略混合前后溶液体积变化)。
②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
| KMnO4酸性溶液 | H2C2O4溶液 |
| 浓度/ mol·L-1 | 体积(mL) | 浓度/ mol·L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
| | | |
则表中a= ;b= ;c= 。
(3)H2C2O4电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②比较H2C2O4和碳酸酸性强弱的方法是 。
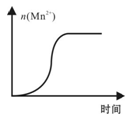
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如右图。请解释n(Mn2+)在反应初始时变化不大、一段时间后快速增大的原因: 。
-
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
| KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | |
| 第一次 | 第二次 | 第三次 |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
| | | | |
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
| KMnO4酸性溶液 | H2C2O4溶液 |
| 浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
| | | |
则表中a= ;b= ;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH 7,理由是 。
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: 。

-
某化学实验小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
| 编号 | 实验操作 | 实验现象 |
| I | 向一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色 |
| II | 向另一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入10滴3 mol/L硫酸,最后加入1 mL 0.1 mol/L草酸溶液 | 80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色 |
(1)写出高锰酸钾与草酸反应的离子方程式:______________________________。
(2)由实验I、II可得出的结论是_______________________________。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验III,验证猜想。提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,_______,最后加入1 mL 0.1 mol/L草酸溶液。

(4)该小组拟采用如图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。你认为他们的实验方案______(填“合理”或“不合理”),理由是___________。
-
下列颜色变化与化学反应无关的是
A.无色NO气体遇空气变为红棕色
B.紫色石蕊试液滴入盐酸中,溶液变红
C.往酸性KMnO4溶液中通入乙烯,溶液褪色
D.往红墨水中投入活性碳,红色褪去
-
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充 分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
A.①②④ B.②③④ C.②③④ D.①③④
-
某实验探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件如下:所用酸性KMnO4溶液的浓度可选择0.010mol·L1、0.001 mol·L1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验酸性KMnO4溶液的用量均为4 mL,H2C2O4溶液(0.100mol·L1)、H2SO4溶液(0.100mol·L1)的用量均为2mL。
(1)写出该实验反应的离子方程式:______________________________________。
(2)请完成实验设计表,并在表中填出对应的实验设计内容:
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/(mol·L1) | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和③探究___________对该反应速率的影响; c. 实验①和④探究催化剂对该反应速率的影响 |
| ② | 298 | 0.5 | 0.001 |
| ③ | 323 | 0.5 | 0.010 |
| ④ | _____ | ______ | ________ |
(3)该反应的催化剂应选择MnCl2还是MnSO4________________。简述选择的理由:____________________________________________________。
(4)某同学对实验①和②分别进行了三次重复实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间t/min |
| 第1次 | 第2次 | 第3次 |
| ① | 12.8 | 13.0 | 11.0 |
| ② | 4.9 | 5.1 | 5.0 |
实验②中用KMnO4的浓度变化表示的平均反应速率为______________________(忽略混合前后溶液的体积变化,结果保留3位有效数字)。该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,即其反应速率越快”的结论,你认为是否正确____________(填“是”或“否”)。他认为不用经过计算,直接根据表中褪色所需时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行_____________(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色所需时间的长短来判断的改进方案:_____________________________.
-
酸性 KMnO4 溶液能与草酸(H2C2O4)溶液反应。某化学探究小组利用反应过程中溶液紫色消失快慢的 方法来研究影响反应速率的因素。
I.实验前首先用浓度为 0.1000 mol/L 酸性 KMnO4 标准溶液滴定未知浓度的草酸溶液。
(1)写出滴定过程中发生反应的离子方程式 。
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 。
A.把 15.8 g KMnO4 固体溶于 1 L 水中所得溶液物质的量浓度为 0.1 mol/L
B.把 0.01 mol KMnO4 固体投入 100 mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1 mol/L
C.需要 90 mL 0.1 mol/L 的 KMnO4 溶液,应准确称量 KMnO4 固体 1 58 g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000 mol/L。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为 8.00 mL)。
| 实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾 溶液 |
| 体积(mL) | 浓度(mol/L) |
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
(3)写出表中实验 1 和实验 2 的实验目的: 。
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验 编号 | 溶液褪色所需时间 (min) |
| 第 1 次 | 第 2 次 | 第 3 次 |
| 1 | 14.0 | 13.0 | 11.0 |
| 2 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“其他条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,甲同学改进了实验方案,请简述甲同学改进 的实验方案______________。
(5)该实验中使用的催化剂应选择 MnSO4 并非 MnCl2,原因可用离子方程式表示为________。
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾。
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入CO2可获得高锰酸钾。
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:______________。
(7)向锰酸钾溶液中通入CO2可获得高锰酸钾,该反应中氧化产物与还原产物的物质的量之比为________________。
-
(共18分)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:
所用酸性KMnO4溶液的浓度可选择0.010 mol·L-1、 0.0010 mol·L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol·L-1)的用量均为2 mL。
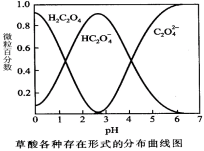
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如下,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式 。
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和 探究温度对反应速率的影响; c.实验①和 探究催化剂对反应速率的影响。 |
| ② | | | |
| ③ | | | 0.010 |
| ④ | | | |
(3)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间 t / min |
| 第1次 | 第2次 | 第3次 |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
| | | |
① 实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行 (填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:
(5)化学催化剂有很多,在生产和科技领域起到重大作用。探究小组又利用乙装置探究MnO2对H2O2分解的催化效果。将50 mL H2O2一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如下图所示。
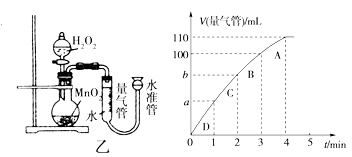
①实验时放出气体的总体积是____ ____mL。
②b______ __(填“大于”“小于”或“等于”)90 mL。
-
(9分)某探究小组通过比较酸性KMnO4溶液与H2C2O4溶液反应过程中,溶液紫色消失时间长短的方法,研究浓度、温度对反应速率的影响。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
| 实验编号 | T/K | KMnO4浓度 /mol·L-1 | H2C2O4浓度 /mol·L-1 | 实验目的 |
| ① | 298 | 0.01 mol·L-1 | 0.1 mol·L-1 | 为以下实验做对照 |
| ② | | | | |
| ③ | | | | 探究浓度对反应速率的影响 |
(2)实验记录:实验中需要记录的数据是。







