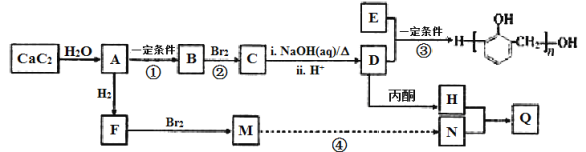
-
化学与生产和生活密切相关,下列有关说法正确的是( )
A.刚玉(Al2O3)硬度仅次于金刚石,熔点也相当高,刚玉坩埚可用于熔融碳酸钾
B.盐析可提纯蛋白质,并保持其生理活性
C.“火树银花”的烟花场景利用的是金属的化学性质
D.石油分馏可得到乙烯、丙烯、丁二烯等短链烃
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异
B.可用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气
C.白炽灯工作时,电能全部转化为光能
D.日本福岛核电站核泄漏事故提醒我们不要开发新能源,要大力挖掘化石能源
难度: 简单查看答案及解析
-
化学与社会、生活、技术和环境密切相关。下列有关说法中不正确的是( )
A.有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低,极易被引燃,加热时最好用水浴加热
B.石油裂解、海水制镁、植物油制人造奶油都包含化学变化
C.大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.苹果放在空气中久置变黄和纸张久置变黄原理不同
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.12.4 g白磷(P4)中所含的P-P键数目为0.6 NA
B.40 g SiC晶体中含有SiC分子的数目为NA个
C.1 mol麦芽糖完全水解后产生的葡萄糖分子数目为NA
D.标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2NA
难度: 中等查看答案及解析
-
某无色溶液能与镁粉作用产生氢气,此溶液中可能大量存在的离子组是( )
A.Ca2+、H+、C1-、NO3- B.K+、Ba2+、AlO2-、Cl-
C.A13+、Fe3+、HCO3-、SO32- D.H+、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
将3.48gFe3O4完全溶解在100mL 1mol·L-1H2SO4溶液中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部反应完,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度为
A.0.033mol·L—1 B.0.3mol·L—1 C.0.2mol·L—1 D.0.1mol·L—1
难度: 中等查看答案及解析
-
将17.9g由Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为25.4g。若HNO3的还原产物仅为NO,则生成NO的标准状况下的体积为( )
A. 2.24L B. 4.48L C. 6.72L D. 8.96L
难度: 困难查看答案及解析
-
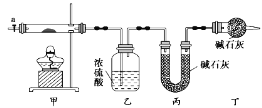
废铁屑制Fe2O3的一种流程如下图:
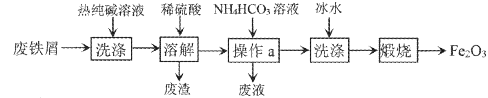
下列说法不正确的是
A. 热的纯碱溶液可去除废铁屑表面的油污
B. 操作a是萃取
C. 冰水既可洗去杂质又可减少固休的溶解
D. Fe2O3可用作红色颜料
难度: 困难查看答案及解析
-
某溶液中有Na+、Mg2+、HSO3-、Cl-、SO42-五种离子,若向其中加入过量的过氧化钠,微热并搅拌,冷却后再加入过量盐酸,溶液中离子的物质的量基本保持不变的是( )
A.Na+ B.Cl- C.Mg2+ D.SO42-
难度: 简单查看答案及解析
-
硫酸亚铁隔绝空气加强热分解形成四氧化三铁,将分解生成的气体通入氯化钡溶液中,下列叙述正确的是
A.产生BaSO4沉淀 B.产生BaSO3沉淀
C.产生BaSO4与BaSO3的混合沉淀 D.无沉淀产生
难度: 中等查看答案及解析
-
食品、大气、工业尾气中SO2均需严格检测或转化吸收,下列有关SO2的检测或吸收方法正确的是
A. 滴定法:用酸性KMnO4溶液滴定葡萄酒试样以测定葡萄酒中SO2的浓度
B. 沉淀法:用Ba(OH)2溶液沉淀SO2,然后将沉淀在空气中洗涤、过滤、干燥、称重以测定大气中SO2的浓度
C. 氨酸法:用氨水吸收尾气中的SO2后再将吸收液与硫酸反应,将富集后的SO2循环使用
D. 石灰—石膏法:常温下用石灰石吸收尾气中的SO2得到CaSO3,再经氧化可用于生产石膏
难度: 中等查看答案及解析
-
类比推理是学习化学的重要的思维方法,下列陈述Ⅰ及类比推理陈述Ⅱ均正确的是( )
陈述Ⅰ
类比推理陈述Ⅱ
A
单质的熔点Br2 < I2
单质的熔点Li < Na
B
工业上电解熔融的Al2O3得到铝单质
工业上电解熔融的MgO得到镁单质
C
还原性:I- > Br-
还原性:P3- > N3-
D
溶解度:CaCO3<Ca(HCO3)2
溶解度:Na2CO3<NaHCO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,A和D同族,C和F同族,B、C、D、E的离子均具有相同的电子层结构,E在同周期元素中离子半径最小。A和B、C、F均能形成共价型化合物,A和B形成的化合物Y在水中呈碱性,D和F形成的化合物在水中呈中性。下列说法错误的是
A.B、D离子的半径大小是B>D
B.化合物AC的沸点比化合物AF的高
C.C的单质能将F单质从EF3的溶液中置换出来
D.化合物AF与化合物Y可反应生成含有共价键的离子化合物
难度: 中等查看答案及解析
-
某有机物键线式的结构如图所示,关于其说法正确的是( )

A.分子式为C8H10O2
B.它的另一种同分异构体
最多有16个原子共平面
C.该有机物的含酯基的芳香族化合物的同分异构体有4种
D.可发生氧化、取代、还原、加成反应
难度: 中等查看答案及解析
-
二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是
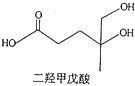
A.与乙醇发生酯化反应生成产物的分子式为C8H18O4
B.能发生加成反应,不能发生取代反应
C.在铜的催化下与氧气反应的产物可以发生银镜反应
D.标准状况下1mol该有机物可以与足量金属钠反应产生22.4LH2
难度: 中等查看答案及解析
-
某温度下,在一个2 L的恒容密闭容器中,加人4mol A和2mol B进行反应:3A(g)+2B(g)
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是20%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
难度: 中等查看答案及解析
-
新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法正确的是
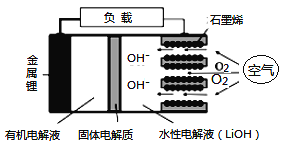
A. Li+穿过固体电解质向正极移动而得到LiOH溶液
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. 放电时,负极反应式:Li-e-+OH-=LiOH
难度: 中等查看答案及解析
-
25℃时,向20 mL 0.0100 mol/L苯酚溶液中滴加0.0100 mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是( )
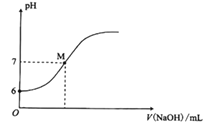
A.25℃时,苯酚的电离常数Ka约为1.0×10-12
B.M点时,所加入NaOH溶液的体积大于10 mL
C.加入20 mLNaOH溶液时,溶液中c(OH-)-c(H+)=c(
)
D.M点时,溶液中的水不发生电离
难度: 中等查看答案及解析
-
已知p(A)=-lg c(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
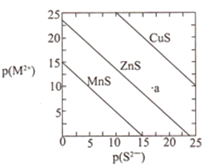
A.a点无ZnS沉淀生成
B.可用MnS除去MnCl2溶液中混有的少量ZnCl2
C.CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=10-20
D.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
难度: 中等查看答案及解析
-
由下列实验现象一定能得出相应结论的是
选项
A
B
C
D
装置图
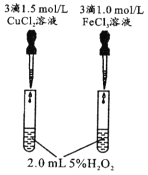
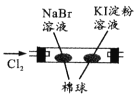
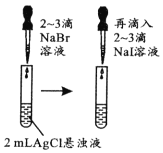
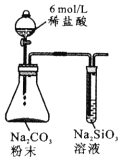
现象
右边试管产生气泡较快
左边棉球变棕黄色,右边棉球变蓝色
试管中先出现淡黄色固体,后出现黄色固体
试管中液体变浑浊
结论
催化活性:Fe3+>Cu2+
氧化性:Br2>I2
Ksp:AgCl>AgBr>AgI
非金属性:C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关实验操作、发生的现象、解释或结论都正确的是 ( )
选项
实验操作
发生的现象
解释或结论
A
向亚硫酸钠溶液中,逐滴加入硝酸酸化的硝酸钡溶液
产生白色沉淀
产生的亚硫酸钡是难溶解入水的沉淀
B
将SO2通入滴有酸性高锰酸钾溶液中
溶液紫红色褪去
SO2具有漂白性
C
常温下铜片插入硝酸中
产生红棕色气体
常温下铜和硝酸一定产生NO2
D
向某溶液中加入NaHCO3
产生白色沉淀
该溶液可能原来含有氢氧化钡
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用下列实验方案及所选玻璃仪器就能实现相应实验目的的是( )
选项
实验目的
实验方案
所选玻璃仪器
A
除去乙酸乙酯中的乙醇
向混合物中加入饱和碳酸钠溶液,混合后振荡,然后静置分液
烧杯、分液漏斗、
玻璃棒
B
检验蔗糖是否水解
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热
试管、烧杯、
酒精灯、胶头滴管
C
证明乙醇发生消去反应生成乙烯
将乙醇与浓硫酸混合加热到170 ℃,将产生的气体通入溴水
酒精灯、圆底烧瓶、
导管、试管
D
比较HClO和CH3COOH的酸性强弱
同温下用pH试纸分别测定浓度为0.1 mol·L-1NaClO溶液、0.1mol·L-1 CH3COONa溶液的pH
玻璃棒、玻璃片
A.A B.B C.C D.D
难度: 简单查看答案及解析