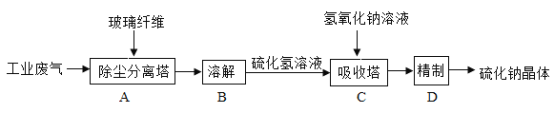
-
化学防晒剂二苯酮被美国接触性皮炎学会选为年度接触性过敏原。二苯酮从20世纪50年代起就被用于防晒霜中,是防晒霜中能吸收紫外线的防晒剂或屏蔽剂。下列一定属于二苯酮化学性质的是( )
A.浅黄色晶体,不溶于水 B.熔点48.1℃,沸点305.9℃
C.密度为1.146g/mL,能升华 D.吸收太阳光中的紫外线能被氧化
难度: 简单查看答案及解析
-
“打赢蓝天保卫战”在行动,实施《大气污染防治行动计划》。下列有关大气污染防治的说法和做法不正确的是( )
A.雾霾天气外出应佩戴防PM2.5 专业口罩
B.加快地方工业发展,无限度使用石油液化气作燃料
C.为了减小污染物对环境的影响,应对私家车实行单双号限行
D.化学科技的进步促进了环境监测和保护
难度: 简单查看答案及解析
-
香椿树的嫩芽香椿被称为“树上蔬菜”,香椿不仅营养丰富,还具有极高的药用价值,含有的皂甙具有抗菌、防癌的作用。下列有关皂甙(化学式为C27H42O3)的说法中正确的是( )
A.皂甙由三种金属元素组成 B.一个皂甙分子中含有72个原子
C.皂甙中氢、氧元素质量为14:1 D.皂甙属于氧化物
难度: 中等查看答案及解析
-
2014年世界水日的宣传主题为“水与能源”。下列有关水的认识与利用中正确的认识是( )
A.工业废水和生活污水不经处理就直接排放
B.水在自然界中的循环为化学变化
C.若不慎将酸溶液溅在皮肤上,应立即用大量水冲洗
D.水通电产生氢气和氧气,说明水中含有氢分子和氧分子
难度: 简单查看答案及解析
-
安徽省地方标准《地理标志产品石台富硒茶》在合肥通过专家审定通过。元素周期表中有关“硒”的信息如图所示。下列关于硒元素说法正确的是( )
A.硒元素符号为Se B.硒是金属元素
C.硒原子的中子数为34 D.硒元素的相对原子质量为78.96g
难度: 简单查看答案及解析
-
实验室利用利用数字化传感器测量实验数据,如图是盐酸和氢氧化钠反应过程中溶液pH变化图像。下列据图分析能得出的结论正确的是( )
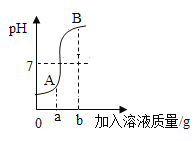
A.该反应是稀盐酸滴入氢氧化钠溶液
B.A点时,溶液的溶质为NaOH和NaCl
C.a g是指加入氢氧化钠固体的质量
D.反应前后所有元素的化合价均无变化
难度: 简单查看答案及解析
-
逻辑推理是一种重要的化学思维方法。下列推理中合理的是( )
A.水和过氧化氢的组成元素相同,所以它们的化学性质相同
B.酸中一定含有氢元素,所以含有氢元素的物质一定是酸
C.某物质在氧气中燃烧生成二氧化碳和水,所以这种物质中一定含有碳、氢、氧元素
D.一切的化学反应遵循质量守恒定律,所以碳酸氢钠加热后固体剩余物质量减轻也符合质量守恒定律
难度: 简单查看答案及解析
-
经实验测定氯化钠和硝酸钾在不同温度的溶解度数据如下表。下列说法不正确的是( )
温度/℃
10
20
30
40
50
NaCl/g
35.8
36.0
36.3
36.6
37.0
KNO3/g
20.9
31.6
45.8
63.9
85.5
A.KNO3 和NaCl的溶解度相等的温度在20℃~30℃之间
B.两种物质的溶解度都随温度的升高而增大
C.在20℃时,10g水中加入5gNaCl可得到质量分数为33.3%的NaCl溶液
D.分别将两种物质的100g饱和溶液从50℃降至10℃,KNO3析出的晶体多
难度: 中等查看答案及解析