-
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是
A. 未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B. 加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C. 加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D. 加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
难度: 中等查看答案及解析
-
常温下,关于pH相等的盐酸和醋酸溶液(两溶液的OH-浓度也相等),下列说法正确的是( )
A. c(HCl)>c(CH3COOH)
B. c(Cl-)=c(CH3COO-)
C. 等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多
D. 用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多
难度: 中等查看答案及解析
-
有① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
A. 3种溶液pH的大小顺序是③>②>①
B. 若将3种溶液稀释相同倍数,pH变化最大的是②
C. 若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D. 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
难度: 中等查看答案及解析
-
己知丙烷的燃烧热△H=-2215KJ·mol-1,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
A. 55 kJ B. 220 kJ C. 550 kJ D. 1108 kJ
难度: 中等查看答案及解析
-
下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
难度: 中等查看答案及解析
-
反应N2(g)+3H2(g)
2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开H-H键的数目和生成N-H键的数目相等
D. 容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
难度: 简单查看答案及解析
-
银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是
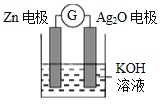
A. Zn电极是负极
B. Ag2O电极发生还原反应
C. Zn电极的电极反应式:Zn-2e-++2OH-=Zn(OH)2
D. 放电前后电解质溶液的pH保持不变
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
(2016•江苏)下列说法正确的是( )
A. 氢氧燃料电池工作时,H2在负极上失去电子
B. 0.1mol/LNa2CO3溶液加热后,溶液的pH减小
C. 常温常压下,22.4LCl2中含有的分子数为6.02×1023个
D. 室温下,稀释0.1mol/L CH3COOH溶液,溶液的导电能力增强
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 纯碱可用于去除物品表面的油污 B. 水可用作钠燃烧的灭火剂
C. 植物秸秆可用于制造酒精 D. 氢氧化铁胶体可用作净水剂
难度: 简单查看答案及解析
-
汽车尾气中NO产生的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是
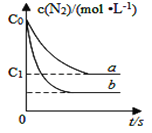
A. 温度T下,该反应的平衡常数
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
难度: 中等查看答案及解析
-
某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,下列说法正确的是
A. AgCl的溶解度、Ksp均减小 B. AgCl的溶解度、Ksp均不变
C. AgCl的溶解度减小、Ksp不变 D. AgCl的溶解度不变、Ksp减小
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
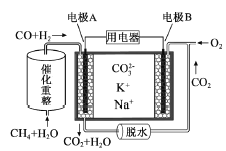
A. 反应CH4+H2O
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 中等查看答案及解析
-
(2015•新课标1)浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当
=2时,若两溶液同时升高温度,则
增大
难度: 中等查看答案及解析
-
下列有关NaClO和NaCl混合溶液的叙述正确的是
A. 该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B. 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C. 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O
D. 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
难度: 困难查看答案及解析
-
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c(ClO-)减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
难度: 中等查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. 0.1 mol/L CH3COONa溶液的pH大于7
C. CH3COOH溶液与NaCO3反应生成CO2
D. 0.1 mol/L CH3COOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
(2016•北京)K2Cr2O7溶液中存在平衡:Cr2O72—(橙色)+H2O⇌2CrO42—(黄色)+2H+ ,用K2Cr2O7溶液进行下列实验:
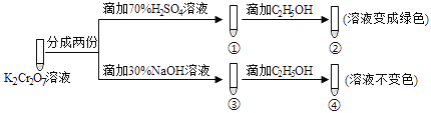
结合实验,下列说法不正确的是( )
A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72—被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
难度: 困难查看答案及解析
-
反应:H2(g)+I2(g)
2HI(g) △H<0,当该反应达到平衡时,下列说法正确的是( )
A. 减小容器体积,平衡向右移动 B. 加入催化剂,HI的产率增大
C. 增大c(I2),H2的转化率增大 D. 升高温度,I2的转化率增大
难度: 中等查看答案及解析
-
10mL浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )
A. K2SO4 B. NaOH C. CuSO4 D. Na2CO3
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 25℃时,向水中加入少量固体NaHSO4,c(H+)增大,Kw不变
B. 向0.1mol·L-1CH3COOH溶液中加入少量的CH3COONa晶体,
减小
C. 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小
D. 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 强电解质溶液的导电能力一定比弱电解质溶液的强
B. 一定温度下,可逆反应2X(g)+Y(g)
2Z(g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
C. 升高温度,AgCl的溶解度增大,Ksp增大
D. FeCl3、KAl(SO4)2、Na2CO3的水溶液均显酸性
难度: 中等查看答案及解析
-
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
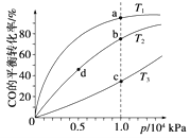
A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c),v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)>M(d)
难度: 困难查看答案及解析
-
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6molC,下列说法正确的是( )
A. 该反应的化学平衡常数表达式是
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 物质发生化学反应时必然伴随着能量变化
B. 金属铜导电,故金属铜是电解质
C. 自发反应都是熵增大的反应
D. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 分子式为C2H6O的有机化合物性质相同
B. 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a:
,途径b:
C. 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数
D. 通过化学变化可以直接将水转变为汽油
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为
。下列说法正确的是
A. 1L0.1mol·
NH4Cl溶液中,
的数量为0.1
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2
难度: 困难查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
难度: 简单查看答案及解析
-
某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列选项正确的是( )
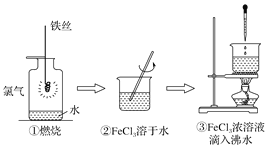
A. 实验①、②所涉及的物质均为电解质
B. 实验②、③均为放热反应实验
C. ②、③均未发生氧化还原反应
D. 实验①、③反应制得的物质均为纯净物
难度: 中等查看答案及解析
-
将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:2A(g)+ B(g)=2C(g),若经2s后测得C的浓度为1.2mol/L,下列说法符合题意是( )
A. 用物质A表示的反应速率为1.2 mol/(L•s)
B. 用物质B表示的反应速率为0.3mol/(L•s)
C. 2s时物质A的转化率为40%
D. 2s时物质B的浓度为0.6mol/L
难度: 简单查看答案及解析
