-
碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称________,可作为碱使用的原因是___________(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ·mol−1
②NaOH(s)+CO2(g)= NaHCO3(s) ΔH1=−131.5 kJ·mol−1
反应2NaHCO3 (s)= Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=_______ kJ·mol−1,该反应的平衡常数表达式K=________。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中 =_____________(保留三位有效数字)。已知Ksp(BaCO3)=2.6×10−9,Ksp(BaSO4)=1.1×10−10。
=_____________(保留三位有效数字)。已知Ksp(BaCO3)=2.6×10−9,Ksp(BaSO4)=1.1×10−10。
(4)已知室温时,Ksp[Mg(OH)2]=4.0×10−11。在0.1 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_____________(已知lg2=0.3) 。
-
I.碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4kJ/mol
②NaOH(s)+CO2(g) = NaHCO3(s) ΔH2=−131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s) +H2O(g) +CO2(g)的ΔH=____kJ/mol,不同温度下NaHCO3分解反应的平衡常数K313K____K298K(填“大于"“小于”或“等于”),该反应的平衡常数表达式K=______。
(2)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中 =____。(保留一位小数,已知Ksp(BaCO3)=2.6×10−9 ,Ksp(BaSO4)=1.1×10−10)
=____。(保留一位小数,已知Ksp(BaCO3)=2.6×10−9 ,Ksp(BaSO4)=1.1×10−10)
II.Mg﹣H2O2电池可用于驱动无人驾驶的潜航器,该电池以海水为电解质溶液,其工作原理如图所示,电池总反应是:Mg+H2O2+2H+═ Mg2++2H2O

(1)负极材料为_____,发生___反应(填“氧化”或“还原”)
(2)两极电极反应式为:
负极:_________________;正极:_________________;
(3)有4.8gMg反应时时,外电路中转移电子数为______。
-
CO2是一种重要的化工原料,依据题给信息,回答下列问题:
Ⅰ.碳酸钠可利用CO2采用氨碱法生产
(1)碳酸钠可作为碱使用的原因是_____________(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ/mol
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=___________ kJ/mol。
Ⅱ.在体积为2 L的密闭容器中,充入1mol/LCO2 和1mol/L H2,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | | | 800 | | 830 | 1000 | 1200 |
| K | 0.6 | | | 0.9 | | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c. υ正(H2)=υ逆(H2O) d. c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
(4)某温度下经2min反应达到平衡后c(CO)=0.8mol/L,此温度下的平衡常数为________。
-
(10分)某化学小组欲以CO2主要为原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究。请你参与并完成对有关问题的解答。
【资料获悉】
1、“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。
2、Na2CO3与盐酸反应是分步进行:Na2CO3先与盐酸反应生成NaHCO3;然后再发生NaHCO3+HCl= NaCl+H2O +CO2↑
【实验设计】

【实验探究】
(1)装置乙的作用是 。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。
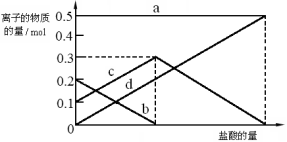
则曲线c对应的溶液中的离子是 (填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 。
(4)若将装置甲产生的纯净的CO22.24L(标准状况下)通入100mLNaOH溶液中,充分反应后,将溶液小心蒸干,得到不含结晶水的固体W,其质量为10.16g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
-
碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
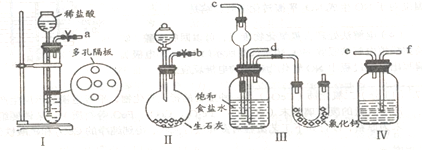
(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2)I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3)第二步中让_____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):
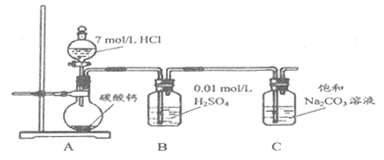
(5)请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
-
碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
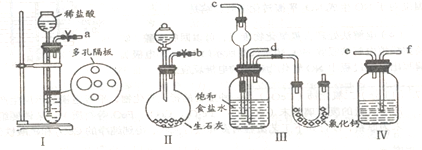
(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2)I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3)第二步中让_____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):
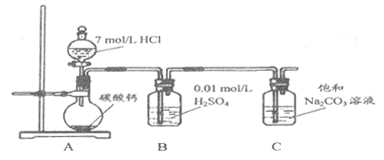
(5)请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
-
碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
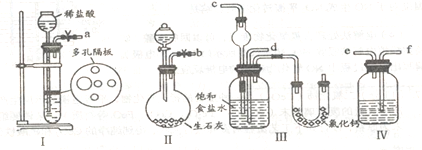
(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2)I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3)第二步中让_____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):
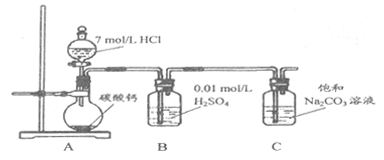
(5)请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
-
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。下列说法不正确的是 ( )。
A.“联合制碱法”和“氨碱法”的化学反应原理中都有下列化学反应
NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+H2O↑+CO2↑
Na2CO3+H2O↑+CO2↑
B.“联合制碱法”生产中有氨的循环利用工艺
C.“氨碱法”生产中有氨的循环利用工艺
D.“联合制碱法”和“氨碱法”都有一定的局限性
-
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___________________________。
(2)写出“联合制碱法”有关反应的化学方程式:_______________________
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______________________。
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:原子利用率(%)=_________________。
-
工业上用粗盐(含Ca2+、Mg2+、 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
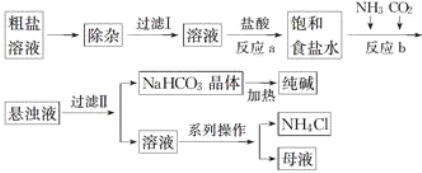
A. 在“侯氏制碱法”中涉及到了氧化还原反应
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 工艺中只有碳酸氢钠加热分解产生的CO2可回收循环利用
=____。(保留一位小数,已知Ksp(BaCO3)=2.6×10−9 ,Ksp(BaSO4)=1.1×10−10)









