-
下列各组品体物质中,“化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A. ③④⑥ B. ①②③ C. ④⑤⑥ D. ①③⑤
难度: 中等查看答案及解析
-
有五种短周期主族元素 X、 Y、 Z、 R、Q, 它们的原子序数逐渐增大,其中X、 Y、 R、Q在周期表中位置如图;R的简单离子半径是同周期中最小的;Z是组成叶绿素的金属元素,其原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol
I4 = 10540kJ/mol。下列说法正确的是( )
X
Y
R
Q
A. 工业上都用电解它们的氧化物方法制Z、R、Q单质
B. X和Y 的单质熔点: X<Y
C. 第一电离能:Q> R > Z
D. Y的简单氢化物可与盐酸反应生成既有离子键又有共价键和配位键的化合物
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. ns电子的能量不一定高于(n-1)p电子的能量
B. 电子排布式(6C)1s22s22p2x违反了洪特规则
C. 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理
D. 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
难度: 中等查看答案及解析
-
下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是( )
A. CCl4、SiCl4、SiH4 B. H2S、NF3、CH4
C. BCl3、NH3、CO2 D. SO3、BF3、H3O+
难度: 简单查看答案及解析
-
电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取( )
A. 电子的运动轨迹图象 B. 原子的吸收光谱
C. 电子体积大小的图象 D. 原子的发射光谱
难度: 中等查看答案及解析
-
硫化羰(OCS)存在于许多种植物中,杀虫效果显著。它与CO2、CS2互为等电子体,已知C=O键的键能为745kJ·mol-1,有关硫化羰的说法正确的是( )
A. 分子中有2个σ键和1个π键
B. 可推测C=S键的键能大于745 kJ·mol-1
C. OCS中碳原子是采用sp杂化方式成键的
D. 分解温度CO2、OCS 、CS2依次由低到高
难度: 中等查看答案及解析
-
下列化学用语的表达正确的是( )
A. 原子核内有10个中子的氧原子:168O
B. 氯原子的结构示意图:
C. 次氯酸的结构式为H﹣O﹣Cl
D. 基态铜原子的外围电子轨道表示式:

难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. Xe元素的所在族的原子的外围电子排布式均为ns2np6,属于非金属元素
B. 在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C. 同一原子的能层越高,s电子云半径越大
D. 某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族
难度: 中等查看答案及解析
-
下列各组表述中,两个微粒不属于同种元素原子的是( )
A. 3p能级有一个空轨道的基态原子和核外电子排布式为1s22s22p63s23p2的基态原子
B. 2p能级无空轨道,且有一个未成对电子的基态原子和最外层电子排布式为2s22p5的基态原子
C. M层全充满而N 层为4s2的基态原子和核外电子排布式为1s22s22p63s23p64s2的基态原子
D. 最外层电子数是核外电子总数的1/5的基态原子和最外层电子排布式为4s24p5的基态原子
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 根据等电子体原理,推测N2O 的结构式可表示为N=N=O
B. 根据等电子体原理,推测O3为非极性分子
C. 分子(HOOC-CHOH-CHCl-COOH) 是一个仅含1个手性碳原子的手性分子
D. 酸性由强到弱排列: HClO4>H3PO4>HCl>HClO
难度: 中等查看答案及解析
-
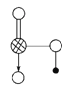
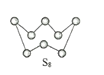
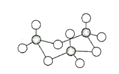
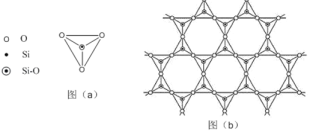
AB型化合物形成的晶体结构多种多样。下图所示的几种结构所表示的物质最有可能是分子晶体的是( )

A. ①③ B. ②⑤ C. ⑤⑥ D. ③④⑤⑥
难度: 简单查看答案及解析
-
以下有关元素性质的说法不正确的是( )
A. 具有下列电子排布式的基态原子中:①1s22s22p63s23p2、②1s22s22p3、③1s22s22p2、④1s22s22p63s23p4。原子半径最大的是①
B. 具有下列价电子排布式的基态原子中:①3s23p1、②3s23p2、③3s23p3、④3s23p4。第一电离能最大的是③
C. ①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl,元素的电负性随原子序数增大而递增的是④
D. 某元素气态基态原子的逐级电离能(单位; kJ·mol-1)分别为738、1451、 7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+
难度: 中等查看答案及解析
-
下列实验事实及理论解释都正确的是( )
选项
实验事实
理论解释
A
酸性: H3BO3、 H2SiO3 相近
B、Si电负性相近,符合“对角线规则”
B
熔点: SiO2> SiCl4
键能:Si-O>Si-Cl
C
密度:干冰>冰
相对分子质量:CO2>H2O
D
沸点: Cl2> N2>CO
CO为极性分子:且相对分子质量:Cl2>CO
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
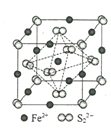
下列关于晶体的说法中,正确的有( )
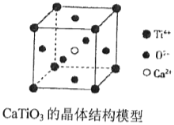
(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
①分子晶体中都存在共价键②在晶体中只要有阳离子就一定有阴离子③铯、钾、钠、钠-钾合金的熔点依次降低④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-相紧邻⑥12g石墨中含有的C-C键的个数为1.5NA(NA为阿伏加德罗常数)⑦晶体中分子间作用力越大,分子越稳定⑧离子晶体CaO的晶格能比KCl高,熔点KCl比CaO低
A. 2种 B. 3种 C. 4种 D. 5种
难度: 中等查看答案及解析
-
下列有关说法不正确的是( )
A. 水合铜离子的模型如图
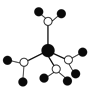 ,1个水合铜离子中有4个配位键
,1个水合铜离子中有4个配位键B. CaF2晶体的晶胞如图
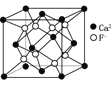 ,每个CaF2晶胞平均占有4个Ca2+
,每个CaF2晶胞平均占有4个Ca2+C. H原子的电子云图如图
 ,H原子核外大多数电子在原子核附近运动
,H原子核外大多数电子在原子核附近运动D. 金属Cu中Cu原子堆积模型如图
 ,为面心立方最密堆积,每个Cu原子的配位数均为12
,为面心立方最密堆积,每个Cu原子的配位数均为12难度: 中等查看答案及解析
-
下列说法不正确的是( )
①N2H4分子中既含极性键又含非极性键②若R2-和M+的电子层结构相同,则原子序数:R>M③F2、Cl2、Br2、I2熔点随相对分子质量增大而升高④NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构⑤固体融化成液体的过程是物理变化,所以不会破坏化学键⑥HF分子很稳定是由于HF分子之间能形成氢键⑦Na2O2固体中的阴离子和阳离子个数比是1∶2⑧由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
A. ②⑤⑥⑧ B. ①③④⑤ C. ②④⑤⑦ D. ③⑤⑦⑧
难度: 中等查看答案及解析
-
通常状况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )
A. 分子中N-Cl键键长比CCl4分子中C-Cl键键长长
B. 分子中不含孤电子对
C. NCl3分子是极性分子
D. NBr3比NCl3易挥发
难度: 中等查看答案及解析
-
下列有关离子晶体的数据大小比较不正确的是( )
A. 晶格能:NaF>NaCl>NaBr B. 硬度:MgO>CaO>BaO
C. 熔点:NaF>MgF2>AlF3 D. 阴离子的配位数:CsCl>NaCl>CaF2
难度: 中等查看答案及解析
-
在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子的最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。下列说法错误的是( )
A. 元素C核外电子占据10个原子轨道
B. B元素在周期表中的d区
C. E的气态氢化物沸点最高的原因是HE分子间形成氢键
D. 元素D 的电子排布式为[Ar]3d104s24p5
难度: 中等查看答案及解析
-
现有T、A、B、C、D、E、F七种前四周期元素,原子序数依次增大。T的原子半径在周期表中最小,基态A原子s能级上电子总数是p能级上电子总数的2倍,基态C原子的价电子排布式为nsnnp2n,D、E位于同主族,且未成对电子数均为0,基态F原子为前四周期元素中未成对电子数最多的元素,根据以上信息下列说法正确的是( )
A. 基态F原子占有15种能量不同的原子轨道
B. T、A、B可组成一种直线型分子,其中δ键和π键数目之比为1:2
C. 分解温度DAC3>EAC3
D. A、B、C的简单氢化物中,最稳定的是C的氢化物,沸点最高的也是C的氢化物
难度: 中等查看答案及解析
-
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )

A. ①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为①1个②2个③4个④4个
C. 晶胞中原子的配位数分别为①6 ②8 ③12 ④12
D. 空间利用率的大小关系为①<②<③<④
难度: 中等查看答案及解析
-
下面有关晶体的叙述中,不正确的是( )
A. 60gSiO2晶体中含Si-O键的个数为4NA(NA为阿伏加德罗常数)
B. 在立方ZnS晶体(如图所示)中,Zn2+、S2-的配位数都是8

C. 设NaCl的摩尔质量为Mg·mol-1,NaCl的密度为ρg·cm-3,阿伏加德罗常数为NAmol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为
cm
D. CaO晶体结构与NaCl晶体结构相似,CaO 晶体中Ca2+的配位数为6,且这些最邻近的O2-围成正八面体
难度: 中等查看答案及解析
-
下列叙述正确的是( )
①不同核素之间形成的共价键一定是极性键②当一个碳原子连接四个不同的原子或原子团时,该碳原子叫手性碳原子③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O,CO2这样的分子⑤冰中存在极性共价键和氢键两种化学键的作用⑥熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、电解质、盐⑦氨水中大部分NH3与H2O以氢键(用“
…”表示)结合成NH3•H2O分子,根据氨水的性质可知NH3•H2O的结构式为⑧σ键重叠方式为头碰头,成镜像对称;ð键重叠方式为肩并肩,成轴对称⑨干冰汽化破坏了共价键,氯化钠溶于水破坏了离子键.
A. ②⑥ B. ①②⑥ C. ②⑤⑥⑧ D. ③④⑥⑦⑨
难度: 中等查看答案及解析
-
长式周期表共有18 个纵行,从左到右排为1﹣18 列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是( )
A. 第9列中元素中没有非金属元素
B. 只有第二列的元素原子最外层电子排布为ns2
C. 第四周期第10列元素是铁元素
D. 第15列元素原子的最外层电子排布为ns2np5
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. PCl3的空间构型为平面三角形
B. HF、HCl、HBr、HI的熔沸点依次升高
C. 乳酸(
)有一对手性异构体,因为其分子中含有一个手性碳原子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
难度: 中等查看答案及解析

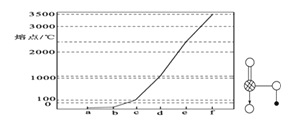
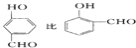 的沸点_____。(填高或低)
的沸点_____。(填高或低)