-
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 |
| 熔点/℃ | −85.5 | 115.2 | >600(分解) | −75.5 | 16.8 | 10.3 |
| 沸点/℃ | −60.3 | 444.6 | −10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态O原子的电子排布图为_______,基态O原子电子占据最高能级的电子云轮廓图为____形,O原子最外层电子的运动状态有_____种。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______________。
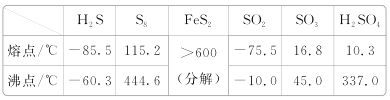
(3)图(a)为S8的结构,该分子中S原子的杂化轨道类型为______________。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________。
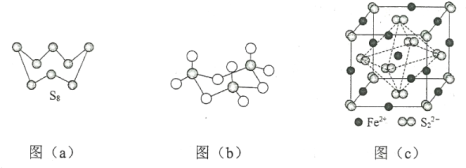
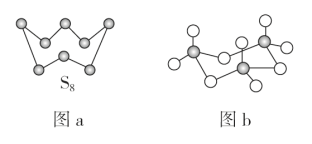
(4)气态三氧化硫以单分子形式存在,其分子中共价键的类型有_______种(根据成键的方式);固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的价层电子数___________。
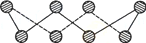
(5)FeS2晶体的晶胞如图(c)所示。晶胞中有Fe2+_____个,有S22-_____个,晶胞中Fe2+位于S22-所形成的_____的体心。
(6)酸性H2SO4 __________H2SO3(填 “>”或 “<”)。
-
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 |
| 熔点/℃ | −85.5 | 115.2 | >600(分解) | −75.5 | 16.8 | 10.3 |
| 沸点/℃ | −60.3 | 444.6 | −10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态O原子的电子排布图为_______,基态O原子电子占据最高能级的电子云轮廓图为____形,O原子最外层电子的运动状态有_____种。
(2)下图为S8的结构,该分子中S原子的杂化轨道类型为______________。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________。
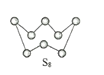
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形;固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的价层电子数___________。
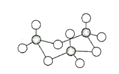
(4)FeS2晶体的晶胞如图所示。晶胞中有Fe2+_____个,有S22-_____个,晶胞中Fe2+位于S22-所形成的____(填空隙名称)的体心。晶胞边长为a nm、FeS2相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g•cm﹣3。
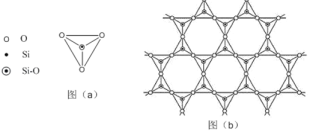
(5)在硅酸盐中,SiO44﹣四面体(如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长层状结构的多硅酸根;其中Si原子的杂化形式为____。该多硅酸根的化学式为_____。
-
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的轨道表示式为_________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___________。
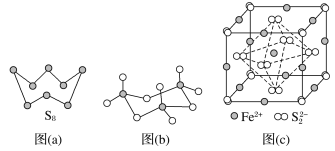
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为____________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______g·cm-3。
-
硫及其化合物有许多用途。相关物质的物理常数如表所示:
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______,基态S原子电子占据最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____。
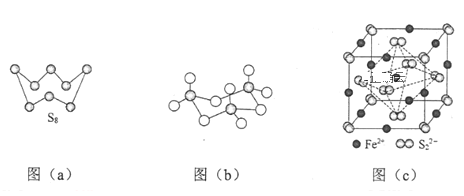
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______。
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______nm。
-
硫及其化合物有许多用途,相关物质的物理常数如表所示:
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)Fe在元素周期表的位置为__,基态S原子电子占据最高能级的电子云轮廓图为__形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___。
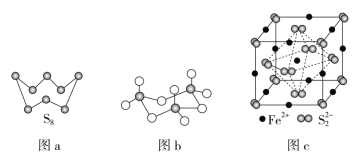
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为__形,其中共价键的类型有__种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为__。
(5)FeS2晶体的晶胞如图c所示。晶胞边长为apm、FeS2的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M的计算表达式为__g·mol-1;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为___pm。
-
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(2)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为__形,其中共价键的类型有___种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为___。
-
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______;
(2) 原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为________________;
(3) Se原子序数为______,其核外M层电子的排布式为______;
(4) H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______,SO32-离子的立体构型为______;
(5) H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,
K2为1.2×10-2,请根据结构与性质的关系解释:
① H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________;
② H2SeO4比H2SeO3酸性强的原因: ______;
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
① H、C、N、O四种元素的电负性由小到大的顺序为_______________________。
② 与CNO-互为等电子体微粒的化学式为_________________(写出一种即可)。
③ 氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________________。
(7)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H―→Rx[CrCln(H2O)6-n]+xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为___
-
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______;
(2)H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______,SO32-离子的立体构型为______;
(3)H2SeO4比H2SeO3酸性强的原因:______;
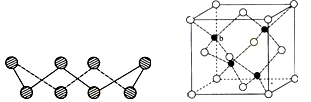
(4)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
-
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是___________;
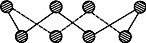
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为________________;
(3)Se原子序数为___________,其核外M层电子的排布式为___________;
(4)H2Se的酸性比H2S_____________(填“强”或“弱”)。气态SeO3分子的立体构型为___________。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是______________。
-
氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________。
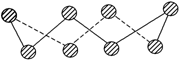
(2)Se原子在元素周期表中位置为 ________;
其基态原子核外价电子的轨道表示式为________。
(3)气态SeO3分子的立体构型为 ________。
(4)H+可与H2O形成H3O+,H3O+中存在的共价键类型为:________。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________________________













