-
甲酸是一种一元有机酸。下列性质可以证明它是弱电解质的是
A.甲酸能与水以任意比互溶
B.1 mol/L甲酸溶液的pH约为2
C.10 mLl1mol/L甲酸恰好与10 mL 1mol/L NaOH溶液完全反应
D.甲酸溶液的导电性比盐酸溶液的弱
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应
B.在同一条件下物质有不同的熵值,其体系的混乱程度越大,熵值越大
C.一个反应能否自发进行取决于反应放热还是吸热
D.一个反应能否自发进行与焓变和熵变的共同影响有关
难度: 中等查看答案及解析
-
下列实验操作和数据记录都正确的是( )
A. 用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2 g
B. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.30 mL
C. 用干燥的广泛pH试纸测稀盐酸的pH=5.1
D. 用10 mL量筒量取NaCl溶液,体积为6.5 mL
难度: 中等查看答案及解析
-
下物质分类组合正确的是 ( )
A
B
C
D
强电解质
HCl
FeCl3
H3PO4
HClO
弱电解质
HF
CH3COOH
NH3·H2O
Ba(OH)2
非电解质
C2H5OH
Zn
H2O
SO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
为了避免电解液中CuSO4因水解发生沉淀,正确的操作方法是
A.稀释 B.加稀硫酸 C.加NaOH溶液 D.加热
难度: 中等查看答案及解析
-
下列关于平衡常数K的说法中,正确的是( )
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④平衡常数K只与温度有关,与反应的本身及浓度、压强无关
A. ①② B. ②③ C. ③④ D. ①③
难度: 中等查看答案及解析
-
某温度下,反应SO2(g) + 1/2O2(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
2SO2(g) + O2(g)的平衡常数K2的值为
A.2500 B.100 C.4×10-4 D.2×10-2
难度: 中等查看答案及解析
-
下列关于盐类水解反应说法正确的是
A.任何盐都可发生水解反应
B.盐只能发生水解反应而不能发生其他反应
C.盐水解反应肯定能破坏水的电离平衡且促进水的电离
D.盐的水溶液为中性时,则盐一定不发生水解反应
难度: 简单查看答案及解析
-
下列电离方程式中书写正确的是( )
A. HF溶于水:HF
H++F- B. NaHCO3
Na++H++CO
C. H3PO4溶于水:H3PO4===3H++PO43- D. H2S
2H++S2-
难度: 中等查看答案及解析
-
下列各离子方程式属于水解反应,且可使溶液呈酸性的是
A.HS-+H2O
H3O++S2- B.NH4++2H2O
NH3·H2O+H3O+
C.HCO3-+OH-
CO32-+ H2O D.CO32- + 2H2O
H2CO3 + 2OH-
难度: 简单查看答案及解析
-
下列有关“电离平衡”的叙述正确的是( )
A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等
B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡
C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动
D.电解质达到电离平衡后,各种离子的浓度相等
难度: 中等查看答案及解析
-
有三种一元酸HA、HB、HC的钠盐分别为NaA、NaB、NaC,它们的物质的量浓度相同时,溶液的PH依次为9,10,8.则这三种弱酸的酸性由强到弱的顺序是( )
A. HA>HB>HC B. HB>HA>HC C. HC>HB>HA D. HC>HA>HB
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A. 强电解质溶液的导电能力一定比弱电解质强。
B. 冰醋酸是弱电解质,液态时能导电。
C. 盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱。
D. 相同温度下,0.1 mol•L-1NH4Cl溶液中NH4+的浓度比0.1 mol•L-1氨水中NH4+的浓度大
难度: 中等查看答案及解析
-
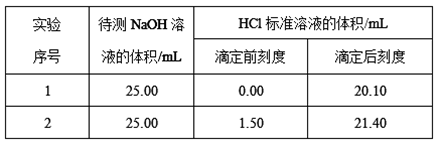
用盐酸作标准液滴定待测浓度的NaOH溶液,若用甲基橙作指示剂,当滴定达终点时,溶液颜色变化是( )
A. 由红色变橙色 B. 由黄色变红色 C. 由黄色变橙色 D. 由橙色变黄色
难度: 简单查看答案及解析
-
浓度均为0.1 mol / L的①NaHCO3、②Na2CO3、③NaCl、④NaHSO4四种溶液,按pH值由小到大排列的顺序是
A. ①②③④ B.④③①② C.③④①② D.②①④③
难度: 中等查看答案及解析
-
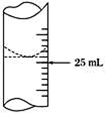
准确量取25.00 mL酸性高锰酸钾溶液,可选用的仪器是( )
A. 500 mL量筒 B. 10 mL量筒
C. 50 mL酸式滴定管 D. 50 mL碱式滴定管
难度: 中等查看答案及解析
-
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是( )
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
难度: 中等查看答案及解析
-
在Na2S溶液中下列关系不正确的是( )
A.c(Na+) =2c( HS-) +2c(S2-) +2c(H2S)
B.c(Na+) +c(H+)=c(OH-)+c(HS-)+ 2c(S2-)
C.c(Na+) > c(S2-) >c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+ c(H2S)
难度: 中等查看答案及解析
-
一定量的盐酸跟足量的铁粉反应时,为了减缓化学反应速率,且不影响生成的H2的总量,可向盐酸中加入适量的 ( )
A. NaOH B. CH3COOH C. 硫酸钾固体 D. CH3COONa固体
难度: 中等查看答案及解析
-
100℃时pH=3的盐酸和pH=9的氢氧化钠溶液以体积比11:9混合,混合液的pH为( )
A. 约3.3 B. 8 C. 6 D. 4
难度: 中等查看答案及解析
-
A. 用蒸馏水洗净酸式滴定管后,注入标准溶液盐酸进行滴定
B. 用蒸馏水洗涤锥形瓶后再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定
C. 用碱式滴定管量取10.00mLNaOH溶液放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和2滴甲基橙试液后进行滴定
D. 若改用移液管取待测液10.00mLNaOH溶液放入锥形瓶后,把留在移液管尖嘴处的液体吹入锥形瓶内,再加入1mL甲基橙指示剂后进行滴定
难度: 中等查看答案及解析
-
在一个恒温恒容的密闭容器中充入1 mol HI,建立如下平衡:2HI(气)
H2(气)+I2(气),测得HI的转化率为a%。保持恒温恒容,在上述平衡体系中再充入2molHI,待新平衡建立后HI的转化率为b%
,则a与b的关系是
A.a>b B.a<b C.a=b D.无法确定
难度: 中等查看答案及解析
-
欲使0.1mol/L的Na2CO3溶液中c(Na+)接近2c(CO2-3),应采取的措施是( )
A. 适当加热 B. 适量加水 C. 适量加盐酸 D. 适量加KOH
难度: 中等查看答案及解析
-
把三氯化铁溶液蒸干灼烧,最后得到的固体产物是
A.无水三氯化铁 B.氢氧化铁
C.氧化亚铁 D.三氧化二铁
难度: 中等查看答案及解析
-
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是
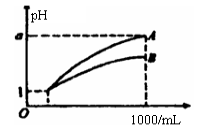
A. A、B两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液的酸性弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
难度: 中等查看答案及解析