-
下列说法不正确的是( )
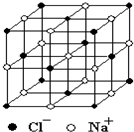
A. 是放射性警示的标志
是放射性警示的标志
B.硅胶常用作袋装食品的干燥剂
C.加碘盐通常添加了适量碘酸钾
D.燃料电池是把反应放出的热能转化为电能的装置难度: 中等查看答案及解析
-
只需一滴,清水就能变高汤--一种颇为神奇的食品添加剂名为“一滴香”,在媒体广受关注.下列观点正确的是( )
A.食品添加剂,通常应提倡多加
B.食品添加剂有害人体健康,应该禁止使用
C.食品添加剂用得恰当,对人体不造成伤害
D.化学融入烹饪学,是人类文明的退步难度: 中等查看答案及解析
-
短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a-b-1),L层电子数为(a+b).则甲、乙两元素形成的化合物具有的性质是( )
①与水反应 ②与硫酸反应 ③与氢氧化钠溶液反应 ④与氯气反应.
A.①②
B.②③
C.②④
D.③④难度: 中等查看答案及解析
-
下列说法正确的是( )
A.用漂白粉等氯制消毒剂杀灭甲流病毒,是因为氯能与病毒发生化合反应
B.能发生银镜反应的有机物一定属于醛
C.淀粉和纤维素的化学式均可写成(C6H10O5)n,它们互为同分异构体
D.肥皂的有效成分是经皂化反应生成的高级脂肪酸钠难度: 中等查看答案及解析
-
下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是( )
A.Na+、Al3+、Cl-、OH-(5:1:4:4)
B.NH4+、Ba2+、OH-、Cl-(1:1:1:2)
C.Fe3+、Na+、Cl-、S2-(1:2:3:1)
D.K+、H+、I-、HCO3-(1:1:1:1)难度: 中等查看答案及解析
-
下列有关原电池和电解池的叙述中正确的是( )
A.钢管大部分浸在淡水中,主要发生析氢腐蚀
B.钢管若采用外加电流的阴极保护措施,应当与电源的正极相连
C.钢管若需保护,可采用牺牲阳极的阴极保护法
D.电解氯化钠溶液时电子从负极经过溶液流向正极难度: 中等查看答案及解析
-
在1L密闭容器中,充入一定量的A发生反应:A(g)
2B(g)(正反应为放热反应).当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡.如图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系.下列说法正确的是( )
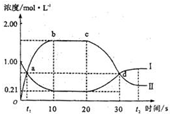
A.a点和d点分别表示两个不同的平衡状态
B.在a点,B的物质的量浓度为0.67mol/L
C.20s~t2s,表示降低温度使平衡移动的过程
D.0s~10s间,用B表示的反应速率为v(B)=1.58mol/难度: 中等查看答案及解析
-
将一定质量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g,则(m1-m2)为( )
A.5.76
B.2.88
C.1.92
D.0难度: 中等查看答案及解析